
化学与生活、生产有着密切关系,下列叙述中正确的是 ( )。
A.钢铁发生析氢腐蚀时,H+得电子释放出H2,钢铁被腐蚀
B.钢铁发生吸氧腐蚀时,OH-失电子释放出O2,钢铁被腐蚀
C.船底镶嵌锌块,锌发生还原反应而被消耗,以保护船体
D.外加电源的正极连接在海水中的钢铁闸门上,可保护闸门
科目:高中化学 来源: 题型:
有关天然产物水解的叙述不正确的是( )
A.油脂水解可得到丙三醇
B.可用碘检验淀粉水解是否完全
C.蛋白质水解的最终产物均为氨基酸
D.纤维素水解与淀粉水解得到的最终产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程中的能量关系可用右图简单表示(图中的ΔH表示生成
1 mol产物的数据)。

(1)写出表示S8燃烧热的热化学方程式________________________________
________________________________________________________________。
(2)写出SO3分解生成SO2和O2的热化学方程式_________________________
_________________________________________________________________。
(3)若已知1个S8分子中有8个硫硫键,硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
选用下列试剂和电极:稀 H2 SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计Ⓖ的指针均明显偏转,则其可能的组合共有 ( )。
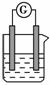
A.6种 B.5种
C.4种 D.3种
查看答案和解析>>
科目:高中化学 来源: 题型:
用选项中的电极、溶液和如图所示装置可组成原电池。下列现象或结论的叙述正确的是 ( )。

| 选项 | 电极a | 电极b | A溶液 | B溶液 | 现象或结论 |
| A | Cu | Zn | CuSO4 | ZnSO4 | 一段时间后,a增加的质量与b减少的质量相等 |
| B | Cu | Zn | 稀 H2SO4 | ZnSO4 | 盐桥中阳离子向b极移动 |
| C | Fe | C | NaCl | FeCl3 | 外电路电子转移方向:b→a |
| D | C | C | FeCl3 | KI、淀粉 混合液 | 若开始时只增大FeCl3溶液浓度,b极附近溶液变蓝的速度加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是 ( )。

A.由TiO2制得1 mol金属Ti,理论上外电路通过2 mol电子
B.阳极的电极反应式为C+2O2--4e-===CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组对电化学问题进行了实验探究。
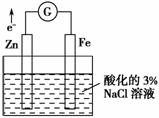
Ⅰ.利用如图所示装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
(1)写出负极的电极反应________
________________________________________________________________。
(2)某学生认为,铁电极可能参与反应,并对产物作出假设。
假设 1 :铁参与反应,被氧化生成Fe2+;
假设 2 :铁参与反应,被氧化生成Fe3+;
假设 3 :________________________________________________________。
(3)为了探究假设1 、2,他采取如下操作:
①取0.01 mol·L-1 FeCl3溶液 2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴 K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴 KSCN 溶液,未见溶液变红。
据②、③、④现象得出的结论是__________________ _____________________________________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施:_________________________________________________________________。
Ⅱ.利用如图所示装置做电解 50 mL 0.5 mol·L-1的 CuCl2 溶液实验。

实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2 的氧化性强于IO );
);
B.电解一段时间以后,阴极表面除吸附有铜外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录 A 中试纸颜色的变化,用离子方程式解释:①________________②______________。
(2)分析实验记录 B 中浅蓝色固体可能是_____________________________
(写化学式),试分析生成该物质的原因:________________________________
________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.1.2 g金刚石中含有的碳碳单键数为0.4NA
B.4.4 g二氧化碳中含有的共用电子对数为0.4NA
C.常温时11.2 L乙烯在氧气中完全燃烧转移的电子数为6.0NA
D.常温下0.1 mol·L-1硝酸铵溶液中,NH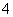 和H+总数一定大于0.1NA
和H+总数一定大于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对各组离子或物质是否能够大量共存解释正确的是
( )。
| A | 常温常压下NH3、O2、H2、CO2 | 不能共存 | NH3为碱性气体、CO2为酸性气体,二者反应生成(NH4)2CO3 |
| B | c(OH-)=1.0×10-13 mol·L-1溶液中,Fe2+、NO | 不能共存 | 发生反应:3Fe2++NO |
| C | 溶液中:K+、Cu2+、Cl-、NH3·H2O | 不能共存 | 发生反应:Cu2++2OH-===Cu(OH)2↓ |
| D | 溶液中:Al3+、Na+、SO | 可以共存 | 不能发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com