
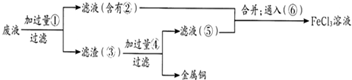
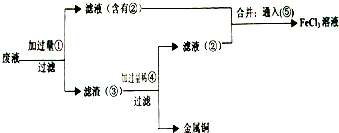
(18分)电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用。按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。

(1)写出FeCl3溶液与铜箔发生反应的化学方程式: 。
(2)检验废腐蚀液中含有Fe3+的实验操作是
(3)“过滤”用到的玻璃仪器有:普通漏斗、 。
(4)废液中加入过量①后,发生反应的离子方程式:
(5)上述流程中取废液200 mL,其中含CuCl2 1.5 mol·L—1、FeCl2 3.0 mol·L—1、FeCl3 1.0 mol·L—1,若要将铜全部回收,需加入Fe粉的质量应不少于_____________g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于_______________mol。
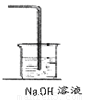
(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。

制备Cl2的化学方程式为:
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂。
(18分)
(1)2FeCl3+ Cu = 2FeCl2+ CuCl2(2分)
(2)取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+(2分,或其它合理答案);
(3)玻璃棒、烧杯(2分)
(4)2Fe3+ + Fe = 3Fe2+ (2分) Cu 2+ + Fe = Fe2+ + Cu(2分)
(5) 22.4 (2分) 0.6 (2分)
(6)MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O (2分)
MnCl2+Cl2↑+2H2O (2分)
 (2分)
(2分)
【解析】
试题分析:根据题干分析:①是铁,②是氯化亚铁,③是铁和铜,④是盐酸,⑤是氯化亚铁,⑥氯气。
(1)氯化铁与铜反应:2FeCl3+ Cu = 2FeCl2+ CuCl2
(2)因为腐蚀液中既有亚铁离子,也有三价铁离子,所以最好用KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+;
(3)根据过滤装置从上到下应该有:烧杯、玻璃棒、漏斗;
(4)废液中CuCl2和FeCl3都要与铁反应:2Fe3+ + Fe = 3Fe2+ , Cu 2+ + Fe = Fe2+ + Cu;
(5)n(Cu2+)=0.3mol;n(Fe3+)=0.2mol,需要n(Fe)=0.3mol+0.1mol=0.4mol,m(Fe)0.4mol×56g/mol=22.4g;混合后溶液中n(Fe2+)=0.8mol,则需要n(Cl2)=0.4mol。
(6)氯气一般用二氧化锰和浓盐酸制取,反应后要用氢氧化钠溶液除去尾气。
考点:考查了Fe3+、Fe2+、Cu2+ 、Cl2的性质,Fe3+的检验、氯气的制取及尾气处理,过滤的装置及尾气处理装置的设计,根据方程式的计算。
点评:由于本题通过废腐蚀液的分离考查了离子检验、气体的制备、装置的设计、仪器的使用、化学反应原理及方程式的计算等,综合性较强,属于难题。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com