
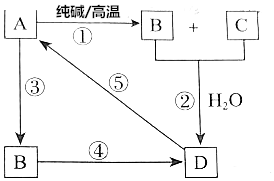
 ��֪A��һ�ֲ�����ˮ��������������ͼ��ʾת����ϵ����������пհף�
��֪A��һ�ֲ�����ˮ��������������ͼ��ʾת����ϵ����������пհף����� A��һ�ֲ�����ˮ��������A�ʹ����ڸ����·�Ӧ����B��C��B��C��ˮ��Һ�з�����Ӧ����D����A��SiO2��A�ܷ�Ӧ����B����B�к���SiԪ�أ�ΪNa2SiO3��CΪCO2��B��Ӧ����D��D��Ӧ����A����D����SiԪ�أ�ΪH2SiO3���ٽ����Ŀ�������
��� �⣺A��һ�ֲ�����ˮ��������A�ʹ����ڸ����·�Ӧ����B��C��B��C��ˮ��Һ�з�����Ӧ����D����A��SiO2��A�ܷ�Ӧ����B����B�к���SiԪ�أ�ΪNa2SiO3��CΪCO2��B��Ӧ����D��D��Ӧ����A����D����SiԪ�أ�ΪH2SiO3��
��1��ͨ�����Ϸ���֪��A��B��D�ֱ���SiO2��Na2SiO3��H2SiO3���ʴ�Ϊ��SiO2��Na2SiO3��H2SiO3��
��2����Ϊ���������̼���Ƶķ�Ӧ�����ɹ����ƺͶ�����̼����Ӧ����ʽΪSiO2+Na2CO3$\frac{\underline{\;����\;}}{\;}$Na2SiO3+CO2����
��Ϊ�����ƺͶ�����̼��ˮ��Ӧ����̼���ƺ��ᣬ���ӷ���ʽΪ SiO32-+CO2+H2O=CO32-+H2SiO3����
��Ϊ���������NaOH��Һ�ķ�Ӧ�����ɹ����ƺ�ˮ�����ӷ���ʽΪSiO2+2OH-=SiO32-+H2O��
��Ϊ�����ƺ���ķ�Ӧ�����ӷ���ʽΪSiO32-+2H+=H2SiO3����
��Ϊ����ķֽⷴӦ�����ɶ��������ˮ����Ӧ����ʽΪH2SiO3$\frac{\underline{\;\;��\;\;}}{\;}$SiO2+H2O��
�ʴ�Ϊ��SiO2+Na2CO3$\frac{\underline{\;����\;}}{\;}$Na2SiO3+CO2���� SiO32-+CO2+H2O=CO32-+H2SiO3����SiO2+2OH-=SiO32-+H2O��SiO32-+2H+=H2SiO3����H2SiO3$\frac{\underline{\;\;��\;\;}}{\;}$SiO2+H2O��
���� ������Si���仯����Ϊ���忼�������ƶϣ���ȷԪ�ػ��������ʼ�����֮���ת���ǽⱾ��ؼ���ע�����֪ʶ���ܽ���ɺ�Ӧ�ã���Ŀ�ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ��/s | 20 | 40 | 60 | 80 | 100 |
| c��NO2 ��/��mol/L�� | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢ� | B�� | �ڢۢ� | C�� | �ڢ� | D�� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2v����B��=v����C�� | B�� | ����ϵ���ܶȶ�����ʱ��仯 | ||
| C�� | 1molA���ѣ�ͬʱ1molCҲ���� | D�� | ����ϵ���¶Ȳ���ʱ����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.35mol/L | B�� | 0.45mol/L | C�� | 0.5mol/L | D�� | 0.6mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��� | ��Ӧ�¶�/�� | c��H2O2��/mol•L-1 | V��H2O2��/mL | m��MnO2��/g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 N��Si�Ǻϳ����ͷǽ������ϵ�������ҪԪ�أ���ش�
N��Si�Ǻϳ����ͷǽ������ϵ�������ҪԪ�أ���ش� ��Siԭ�ӿ��γɶ����⻯�����Si2H6��Siԭ�ӵļ۲���Ӷ���ĿΪ4��
��Siԭ�ӿ��γɶ����⻯�����Si2H6��Siԭ�ӵļ۲���Ӷ���ĿΪ4���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com