
| A. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| B. | 用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用水鉴别乙醇、苯和溴苯 |
分析 A.乙醇燃烧有淡蓝色火焰,苯燃烧有黑烟,四氯化碳不燃烧;
B.苯、环己烷均与高锰酸钾不反应,分层现象相同;
C.乙醇与碳酸钠不反应不分层、乙酸与碳酸钠反应生成气体,碳酸钠与乙酸乙酯分层;
D.乙醇与水互溶,苯与水分层后有机层在上层,溴苯与水分层后有机层在下层.
解答 解:A.乙醇燃烧有淡蓝色火焰,苯燃烧有黑烟,四氯化碳不燃烧,现象不同可鉴别,故A正确;
B.苯、环己烷均与高锰酸钾不反应,分层现象相同,不能鉴别,故B错误;
C.乙醇与碳酸钠不反应不分层、乙酸与碳酸钠反应生成气体,碳酸钠与乙酸乙酯分层,现象不同可鉴别,故C正确;
D.乙醇与水互溶,苯与水分层后有机层在上层,溴苯与水分层后有机层在下层,现象不同可鉴别,故D正确;
故选B.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与应用能力的考查,注意有机物性质的综合应用,题目难度不大.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 石膏(CaSO4•2H2O) | B. | 硫铁矿(FeS2) | ||
| C. | 纯碱(NaHCO3) | D. | 芒硝(Na2SO4•10H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
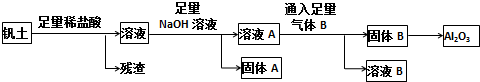
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -OH的电子式: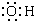 | |
| B. | 硫离子结构示意图: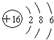 | |
| C. | 氢氧化铜电离方程式:Cu(OH)2═Cu2++2OH- | |
| D. | 乙酸的分子式:C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和C3H6 | B. | CH4和C2H4 | C. | CH4和C3H8 | D. | CH4和C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.9 | 3.3 | 9.4 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com