
【题目】实验小组的同学对一粗盐样品进行初步提纯。所用实验仪器或用品如下

(1)D的名称是__________。
(2)提纯的步骤是:溶解、过滤、__________。
(3)“过滤”操作的要点可概括为“一贴、二低、三靠”,其中的“二低”是__________、__________。
(4)该实验中多次利用仪器B__________(填名称)和仪器__________(填字母序号),且该仪器使用了__________次。
【答案】蒸发皿蒸发滤纸上沿低于漏斗边缘液面低于滤纸上沿烧杯F3
【解析】
(1)根据仪器的构造可知D为蒸发皿;
(2)粗盐提纯是通过把粗盐配制成溶液-溶解,把不溶物除去-过滤,然后把食盐从溶液中分离出来而得到精盐-蒸发的过程,即步骤为溶解、过滤、蒸发;
(3)如果滤纸边缘高于漏斗边缘,过滤器内的液体有可能溢出;如果漏斗内液面高于滤纸边缘,液体也会顺着漏斗与滤纸间的夹缝流下,这样都会导致过滤失败,所以二低的含义为:滤纸上沿低于漏斗边缘,液面低于滤纸上沿;
(4)在溶解过程中利用烧杯作容器,玻璃棒作搅拌棒;在过滤时利用烧杯盛接滤液,利用玻璃棒引流;在蒸发时利用玻璃棒搅拌,使溶液均匀受热,该实验中多次用到烧杯和玻璃棒,其中玻璃棒使用了三次。


科目:高中化学 来源: 题型:
【题目】麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示。下列有关麦考酚酸说法正确的是( )

A. 分子式为C17H23O6
B. 不能与FeCl3溶液发生显色反应
C. 在一定条件下可发生加成、取代、消去反应
D. 1 mol麦考酚酸最多能与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一。我省某工厂以重晶石为原料,生产“电子陶瓷工业支柱”——钛酸钡(BaTiO3)的工艺流程如下:

查阅资料可知:
①常温下: Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9
②TiC14在常温下是无色液体,遇水容易发生水解:TiCl4+2H2O=TiO2+4HCl。
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O。
请回答下列问题:
(1)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该过程用离子方程式可表示为___________,此反应的平衡常数K=____ (填写计算结果)。若不考虑CO32- 的水解,则至少需要使用_____mol/L 的Na2CO3溶液浸泡重晶石才能实现该转化过程。
(2)酸浸时所发生反应的离子方程式为___________________________________。
(3)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_____________________。
(4)可循环使用的物质X 是_________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_____________________________________________________________。
(5)煅烧草酸氧钛钡晶体得到BaTiO3的同时,高温下生成的气体产物有CO、__________和_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其他条件不变,增大反应物的浓度能增大反应速率的原因是
A. 单位体积内分子数增多 B. 单位体积内活化分子数增多
C. 活化分子百分数增大 D. 分子碰撞的次数增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】广泛用于纺织工业的连二亚硫酸钠(Na2S2O4),俗称保险粉,是一种强还原剂,可溶于水,但不溶于乙醇,在碱性介质中稳定。
Ⅰ.工业上制备连二亚硫酸钠的流程如下:

请回答下列问题:
(1)步骤①中的化学方程式为___________________________________;
(2)步骤②中沉淀为_________________________________(填化学式);
(3)步骤③中加入NaCl 固体的作用是______________________________,分离出保险粉方法为_______、洗涤、干燥,洗涤所用试剂是___________________________。
Ⅱ.工业上也可用右图装置电解NaHSO3溶液制Na2S2O4。
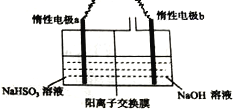
(1)惰性电极a连接电源的_________(填“正极”或“负极”),其电极反应式为________________;
(2)若不加隔膜,则得不到连二亚硫酸钠,其原因是____________________________。
Ⅲ.探究Na2S2O4的性质:
某课题小组常温下测定0.050 molL-1Na2S2O4溶液在空气中的pH变化如下图所示;
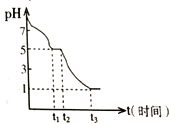
(1)0-t1段主要生成HSO3-,根据pH变化图,写出0- t1发生反应的离子方程式为______________;
(2)若t1时溶液中Na2S2O4全部被氧化成NaHSO3,此时溶液中c(SO32-)-c(H2SO3) =__________ molL-1(填具体数值,不考虑溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于第三周期从左到右的主族元素,下列说法中不正确的是( )
A.原子半径逐渐减小
B.电子层数逐渐增多
C.最高正化合价逐渐增大
D.元素的非金属性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。

请根据混合物分离或提纯原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去Ca(OH)2溶液中悬浮的CaCO3 ___________;(2)用自来水制取蒸馏水 ___________;(3)分离植物油和水 ___________;(4)与海水晒盐原理相符的是 ___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com