
【题目】晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钻、钙等多种化学物质。
请回答下列问题:
(1) 区分晶体硼和无定形硼最可靠的科学方法为___________。第二周期元素的电负性按由小到大的顺序排列,B元素排在第__________位,其基态原子价层电子的电子云轮廊图为 _______________。
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为____________,Si原子的杂化类型为__________________。
(3) N元素位于元素周期表_____________区;基态N原子中,核外电子占据最高能级的电子云有______伸展方向。

(4)[Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供_______________个空轨道。
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成_____________种不同的结构形式。
(5)—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有___________________个。
②若Ca与O之间的最短距离为α pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g· cm-3(用含α、NA的代数式表示)。
【答案】 X-射线衍射实验 3 球形、哑铃形 (或纺锤形) SiO32- [或(SiO3)n2n-] sp3 p 3 6 2 8 ![]()
【解析】(1)区分晶体和非晶体的最可靠的科学方法为X-射线衍射实验。同周期主族元素的电负性从左到右依次增强,所以B元素排在第三位。基态B原子的价层电子排布式为2s22p1,其中s能级的电子云轮廓图为球形,p能级的电子云晶体为哑铃形或纺锤形;(2)由图1可知,无限长链状结构的硅酸根的化学式为SiO32-,其中Si原子的价层电子对数是4,所以杂化轨道类型是sp3;(3)基态N原子的价层电子排布式 2s22p3,所以属于p区。p能级有3个轨道,因此电子云有3个伸展方向;(4)①1个Co离子有6个NH3分子作配体,每个配体提供1对孤对电子,故1个Co离子需提供6个空轨道。②由信息:[Co(NH3)6]3+的几何构型为正八面体形,Co在中心可推知,如果两个NH3分子换成两个Cl-,可替换邻位和对位,共有两种不同结构形式。(5)①根据均摊法可知每个晶胞中实际占用1个Ca、1个Ti、3个O,由晶胞结构可知与1个Ca紧邻的Ti有8个,根据二者的原子数目之比为1:1可知,与1个Ti紧邻的Ca也有8个;②根据晶胞结构可知,Ca与O原子核之间的最短距离为面对角线的一半,则晶胞棱长为![]() ,则晶体的密度
,则晶体的密度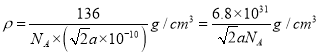 。
。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】锌与100mL 18.5mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的pH=1。下列叙述不正确的是( )
A. 气体甲中SO2与H2的体积比为4∶1 B. 反应中共消耗1.8mol H2SO4
C. 反应中共消耗97.5g Zn D. 反应中共转移3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法中正确的是( )
A. 原子最外层电子数为2的元素全部在第ⅡA族和第ⅡB族
B. 副族是完全由长周期元素构成的族
C. 每个横行是一个周期,每个纵行是一个族
D. 第ⅠA族又称碱金属元素,第ⅦA族又称卤族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
A. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热)
B. NaOH(aq)+HI(aq)=NaI(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(中和热)
C. S(s)+![]() O2(g)=SO3(g) ΔH=-296.8 kJ·mol-1(燃烧热)
O2(g)=SO3(g) ΔH=-296.8 kJ·mol-1(燃烧热)
D. 2NO2=O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F属于短周期主族元素.A的原子半径是短周期中最大,B元素的原子最外层电子数为m、次外层电子数为n,C元素的原子L层电子数为m+n,M层电子数为m﹣n,D元素与C元素同主族,E元素原子与B元素原子的核外电子数之比为2:1,F的一种原子中,质量数与质子数之差为零.
(1)B2﹣的离子结构示意图 , DE2的电子式 .
(2)A、B形成的简单离子的半径由大到小的顺序为(用具体符号表示).
(3)A、E形成的是(填共价或离子)化合物
(4)C在周期表中的位置是
(5)由元素C形成的单质Y与由A,B,F三种元素形成的化合物X的水溶液反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、C、N、Si是几种常见的重要非金属元素,其形成的各种化合物在自然界中广泛存在。
⑴ 基态硼原子的电子排布式为___________________________。C、N、Si元素原子的第一电离能由大到小的顺序为____________________________。
⑵ BF3与一定量的水可形成如图晶体R。

① 晶体R中各种微粒间的作用力涉及______(填字母)。
a.离子键 b.共价键 c.配位键
d.金属键 e.范德华力
② R中阴离子的空间构型为_______________。
⑶ 乙二胺(H2NCH2CH2NH2)与CuCl2溶液可形成配离子(结构如图) 乙二胺分子中氮原子的杂化类型为______。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是________________________________。

⑷ 氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。它的晶体结构如图所示。六方相氮化硼是否含有π键?______(填 “含”或“不含”),其质地软的原因是______________________________________,该物质能否导电?______(填“能”或“不能”),其原因是_________________。

⑸ SiC是原子晶体,其晶胞结构类似金刚石,假设正方体的边长为a cm,估算SiC晶体的密度为_______gcm3(用含NA、a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com