
| A. | 提纯含有杂质的工业乙醇,常用的方法是蒸馏 | |
| B. | 常温下,将二氧化碳通入苯酚钠溶液,溶液会变浑浊 | |
| C. | 混有泥沙的苯甲酸,除去杂质的方法是将其溶解后过滤,再蒸发结晶即可 | |
| D. | 苯和苯酚稀溶液分别与浓溴水混合,后者产生白色沉淀 |
分析 A.乙醇与杂质互溶,但沸点不同;
B.二氧化碳与苯酚钠反应生成苯酚和碳酸氢钠,苯酚的溶解度不大;
C.应趁热过滤除去苯甲酸中混有的泥沙;
D.苯酚与浓溴水反应生成三溴苯酚沉淀,而苯与溴水不反应.
解答 解:A.乙醇与杂质互溶,但沸点不同,则提纯含有杂质的工业乙醇,常用的方法是蒸馏,故A正确;
B.二氧化碳与苯酚钠反应生成苯酚和碳酸氢钠,苯酚的溶解度不大,则常温下,将二氧化碳通入苯酚钠溶液,溶液会变浑浊,故B正确;
C.苯甲酸的溶解度随温度升高而增大,蒸发结晶析出苯甲酸晶体,应趁热过滤除去苯甲酸中混有的泥沙,故C错误;
D.苯酚与浓溴水反应生成三溴苯酚沉淀,而苯与溴水不反应,现象合理,故D正确;
故选C.
点评 本题考查较综合,涉及有机物的结构与性质、混合物分离提纯等,为高频考点,把握官能团与性质的关系、物质的性质差异等为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
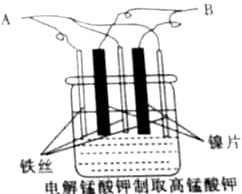 制备KMnO4的最佳方法是电解法,实验室以镍片(不参与反应)和铁丝作电极,电解K2MnO4的水溶液(绿色)制备KMnO4,装置如图:
制备KMnO4的最佳方法是电解法,实验室以镍片(不参与反应)和铁丝作电极,电解K2MnO4的水溶液(绿色)制备KMnO4,装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高体系温度,平衡常数K减小 | |
| B. | 增大体系压强,平衡常数K不发生变化 | |
| C. | 平衡常数表达式为K=$\frac{[CO][{H}_{2}]}{[C][{H}_{2}O]}$ | |
| D. | 增加C(s)的量,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
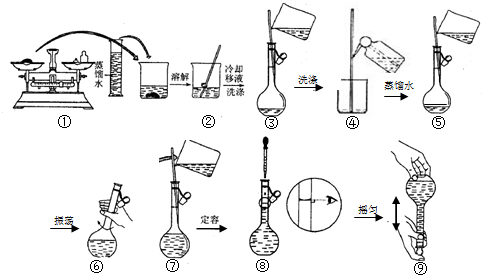
| A. | 用托盘天平称取5.85g NaCl固体 | |
| B. | 将称出的固体在容量瓶中充分溶解 | |
| C. | 将烧杯紧靠容量瓶的瓶口转移溶液 | |
| D. | 当液面距离量瓶瓶颈的刻度线下1~2cm时,改用胶头滴管定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述生成Ni(CO)4的反应为放热反应 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol•L-1,则此时v正>v逆 | |
| C. | 25℃时反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为2×10-5 | |
| D. | 80℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
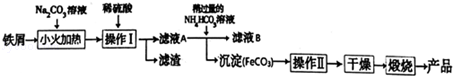
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com