
| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| B. | 对于能够自发进行的吸热反应,其原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
分析 A.△H-T△S<0为判断反应进行的综合判据;
B.对于能够自发进行的吸热反应,△H>0,且△H-T△S<0;
C.△H-T△S<0的反应可自发进行;
D.催化剂只改变反应速率,不改变反应的方向.
解答 解:A.△H-T△S<0为判断反应进行的综合判据,则焓变或熵变不能单独作为反应自发性的判据,故A错误;
B.对于能够自发进行的吸热反应,△H>0,且△H-T△S<0,则体系有自发地向混乱度增加的方向转变的倾向,即△S>0,故B正确;
C.△H-T△S<0的反应可自发进行,则△H<0、△S>0的反应在温度低时能自发进行,故C错误;
D.使用催化剂,不能改变化学反应进行的方向,故D错误;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握判断反应进行的判据为解答的关键,侧重分析与应用能力的考查,注意不能单独使用焓变、熵变判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 4 mol A+2 mol B | |
| B. | 1 mol B+3 mol C+1 mol D | |
| C. | 3 mol C+2 mol D | |
| D. | 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
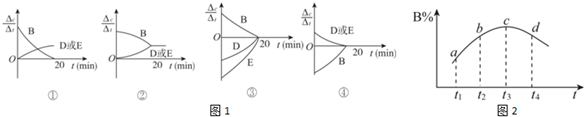
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
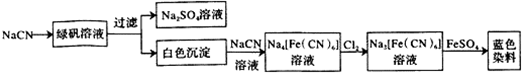
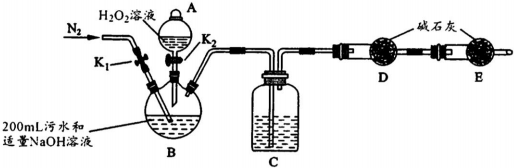
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热. |
| 步骤2 | 冷却后,用注射器穿过B装置的胶塞注入稀H2S04溶液. |
| 步骤3 | 打开K1,通入N2. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
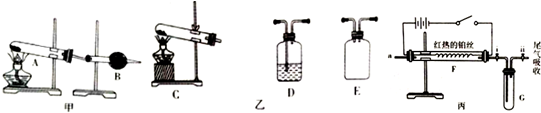
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H2>△H1,△H4>△H3 | B. | △H1>△H2,△H4>△H3 | C. | △H1>△H2,△H3>△H4 | D. | △H2>△H1,△H3>△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水是一种很好的溶剂 | B. | 水在人体内还有调节体温的作用 | ||
| C. | 饮用水越纯净对身体越好 | D. | 水是反应介质和反应物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com