
| A. | 稀盐酸溶液,NaAlO2溶液 | B. | 浓氨水,AgNO3溶液 | ||
| C. | NaOH溶液,AlCl3溶液 | D. | Cu,FeCl3溶液 |
分析 A、稀盐酸不足生成氢氧化铝,稀盐酸过量生成氯化铝;
B、从氢氧化银能容于过量的氨水分析;
C、氢氧化钠过量生成偏铝酸钠,氯化铝过量生成氢氧化铝沉淀;
D、发生的是氧化还原反应,过量的物质不能继续反应.
解答 解;A、稀盐酸溶液加入NaAlO2溶液发生的反应NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,Al(OH)3+3HCl=AlCl3+3H2O,量不同,生成产物不同,故A不符合;
B、浓氨水加入AgNO3溶液发生反应NH3•H2O+AgNO3=AgOH↓+NH4NO3,AgOH+2NH3•H2O=Ag(NH3)2OH+2H2O,量不同,生成产物不同,故B不符合;
C、氢氧化钠过量生成偏铝酸钠,氯化铝过量生成氢氧化铝沉淀,不能用同一个化学方程式表示,故C不符合;
D、Cu加入FeCl3溶液只发生反应Cu+2FeCl3=2FeCl2+CuCl2,铜过量不再反应,故D符合;
故选D.
点评 本题考查了物质反应随量的不同产物不同,同时考查了偏铝酸钠、氢氧化铝、氢氧化银、氯化铁等物质的性质.


科目:高中化学 来源: 题型:选择题
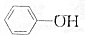 ,③
,③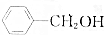 ,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根据官能团的不同可分为( )
,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根据官能团的不同可分为( )| A. | 3类 | B. | 4类 | C. | 5类 | D. | 6类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释10000倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸溶液的pH=3,则1.0×10-8mol/L盐酸溶液的pH=8 | |
| D. | 某温度下水的离子积为1.0×10-12,等体积的pH=1的H2SO4溶液与pH=11的NaOH溶液混合后溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 | |
| D. | 2V正(CrO42-)=V逆(Cr2O72-)时,反应处于平衡态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 | |
| C. | 工业上常用电解C、D的盐溶液来制备C、D元素的单质 | |
| D. | 化合物AE与CE有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的氢化物和E的氢化物能反应,且得到的产物只含有共价键 | |
| B. | C在元素周期表中的位置是第三周期第ⅠA族 | |
| C. | 五种原子中E的原子半径最大 | |
| D. | A的最低价氢化物的沸点>B的最低价氢化物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性(酸性溶液):Co(OH)3>FeCl3>I2 | B. | 还原性(碱性溶液):I2>Fe(OH)2>KIO3 | ||
| C. | 热稳定性:NaCl>NaClO4>NaClO | D. | 酸性(水溶液):HSCN>H2CO3>HCN |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com