
分析 求出氢氧化钠的物质的量,然后根据c=$\frac{n}{V}$计算物质的量浓度,从而计算出氢离子浓度c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$和pH=-lgc(H+);
将此溶液加水稀释到2升,则先求出溶液中的c(OH-),然后计算出氢离子浓度c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$和pH=-lgc(H+);
取最初溶液500毫升与0.1mol/L的盐酸等体积混合后,两者恰好完全反应,据此判断溶液的酸碱性和pH;
再取稀释后的溶液500毫升与0.1mol/L的盐酸等体积混合后,盐酸过量,溶液显酸性,混合后溶液中的c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{混}}$,据此求出pH;
另取0.15mol/L的氢氧化钡溶液1L与原溶液混合(假设混合后溶液的体积不变)后,碱过量,先求溶液中的c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$,然后根据c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$和pH=-lgc(H+)来计算;温度不变,则水的离子积不变.
解答 解:4g氢氧化钠的物质的量为0.1mol,配制成1L溶液后溶液的物质的量浓度c=$\frac{n}{V}$=$\frac{0.1mol}{1L}$=0.1mol/L,则溶液中的氢离子浓度c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.1}$=10-13mol/L,pH=-lgc(H+)=13;
将此溶液加水稀释到2升,则稀释后溶液中的c(OH-)=$\frac{0.1mol/L}{2}$=0.05mol/L,则氢离子浓度c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.05}$=2×10-13mol/L,则pH=-lgc(H+)=12.7;
由于最初的溶液的物质的量浓度为0.1mol/L,故取最初溶液500毫升与0.1mol/L的盐酸等体积混合后,两者恰好完全反应,溶液的酸碱性显中性,pH=7;
再取稀释后的溶液500毫升与0.1mol/L的盐酸等体积混合后,由于稀释后溶液的浓度为0.05mol/L,故盐酸过量,溶液显酸性,混合后溶液中的c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{混}}$=$\frac{0.1mol/L×0.5L-0.05mol/L×0.5L}{1L}$=0.025mol/L,则pH=-lgc(H+)=1.82;
另取0.15mol/L的氢氧化钡溶液1L与原溶液混合(假设混合后溶液的体积不变)后,碱过量,溶液中的c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$=$\frac{0.3mol/L×1L-0.1mol/L×1L}{2L}$=0.1mol/L,则c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.1}$=10-13mol/L,则pH=-lgc(H+)=13;由于温度不变,则水的离子积不变.将此溶液温度升高,水的离子积常数增大.
故答案为:13;12.7;中性;7;酸性;1.82;13;不变;变大.
点评 本题考查物质的量浓度的计算和混合溶液的pH的计算,题目难度不大,注意有关公式的熟练运用.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol O2完全反应时,转移的电子数为0.4NA | |
| B. | 用惰性电极点解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 含1mol FeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| D. | 1mol 葡萄糖与足量的钠反应能产生2.5mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液 | |
| B. | 某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物 | |
| C. | 用过滤法无法除去Fe(OH)3胶体中的FeCl3 | |
| D. | 升高温度纯水的离子积增大,但pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)在室温下不能自发进行,说明该反应的△H<0 | |
| B. | 焓变和熵变是判断反应方向的两个主要因素 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 | |
| D. | 任何情况下,温度都不可能对反应的方向起决定性作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制硫酸亚铁溶液时,通常在溶液中加入少量的稀硫酸和铁 | |
| B. | 向BaCl2溶液中滴加稀硫酸的过程中,溶液的导电能力不变 | |
| C. | 向某溶液中加入澄清石灰水,溶液变浑浊,则该溶液一定含有CO32- | |
| D. | 把SO2通入盛有滴加了酚酞的NaOH溶液中,溶液褪色,说明SO2有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
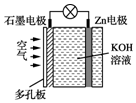
| A. | 电池放电时Zn电极逐渐溶解 | |
| B. | 石墨为正极 | |
| C. | 电子由石墨经导线流向Zn片 | |
| D. | 电池放电时实现了化学能向电能的转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com