
【题目】烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:![]() 被氧化为
被氧化为![]() 和
和![]()
![]() 、
、![]() 、
、![]() 、
、![]() 表示烃基或氢原子
表示烃基或氢原子![]() 。由此推断分子式为
。由此推断分子式为![]() 的烯烃所有可能的氧化产物有( )
的烯烃所有可能的氧化产物有( )
A. 5种B. 6种C. 7种D. 8种
【答案】C
【解析】
先根据碳链异构与位置异构写出分子式为C5H10的烯烃的同分异构体,然后根据题中提供的信息,分析碳碳双键被氧化断裂的情况,从而得出氧化产物的种类。
C5H10的烯烃的同分异构体有:①CH2═CH-CH2-CH2-CH3、②CH3-CH═CH-CH2-CH3、③CH2═C(CH3)CH2CH3、④CH3C(CH3)═CHCH3、⑤CH3CH(CH3)CH═CH2。
①CH2═CH-CH2-CH2-CH3,双键被氧化断裂生成的氧化产物为HCHO、CH3-CH2-CH2-CHO,
②CH3-CH═CH-CH2-CH3,双键被氧化断裂生成的氧化产物为CH3-CHO、CH3-CH2-CHO,
③CH2═C(CH3)CH2CH3,双键被氧化断裂生成的氧化产物为HCHO、CH3COCH2CH3,
④CH3C(CH3)═CHCH3,双键被氧化断裂生成的氧化产物为CH3COCH3、CH3-CHO,
⑤CH3CH(CH3)CH═CH2,双键被氧化断裂生成的氧化产物为CH3CH(CH3)CHO、HCHO,
因此共得到7种氧化产物,故选C。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c1∶c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇(C2H5OH)是生活中常见的物质,下图给出了乙醇的结构式和球棍模型。
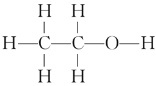

I.乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
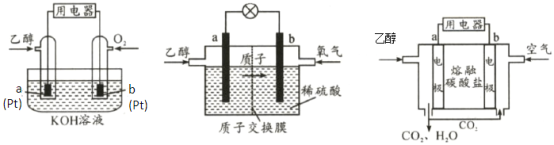
碱性乙醇燃料电池 酸性乙醇燃料电池 熔融盐乙醇燃料电池
(1)三种乙醇燃料电池中正极反应物均为_______。(填化学式)
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为_______,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是_______。
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为_______。
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极_______(填“a”或“b”)移动。
II. 已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g)![]() CH3CH2OH(g)。当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如下图:
CH3CH2OH(g)。当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如下图:
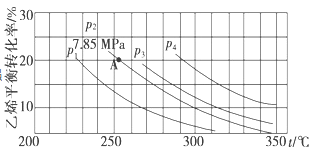
(1)图中压强p1、p2、p3、p4的大小顺序为:_______,理由是:_______。
(2)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9 MPa,n(H2O):n(C2H4)=0.6:1。该条件下乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴被誉为战略物资,有出色的性能和广泛的应用.以水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、A12O3、MnO等)制取钴产品的工艺流程如下:

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Mn(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程、Co2O3发生反应的离子方程式:_________________________。
(2)写出NaC1O3发生反应的主要离子方程式:______________________________;
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为____________________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________________;萃取剂使用的最佳pH范围是__________(填代号)。
A.1.0~1.5 B.2.0~2.5 C.3.0~3.5 D.4.0~4.5

(5)“沉钴”时生成CoCO3的离子方程式为__________________________________。
(6)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将 A、B气体各1 mol充入2L恒容密闭容器,发生反应A(g)+B(g)![]() xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是( )
xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是( )

A. 反应方程式中的x=1
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是移去少量物质D
D. t1~t3间该反应的平衡常数均为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:

(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为__________________________。
(5)滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产是指对原料进行化学加工,最终获得有价值的产品的生产过程。某研究小组利用含硫酸亚铁和硫酸铜的工业废料制备铁红(氧化铁)和硫酸铵晶体。流程如图:
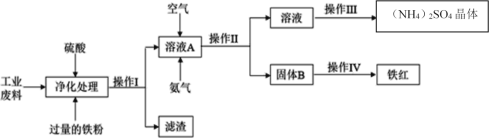
请回答下列问题:
(1)操作I的名称_____,操作Ⅲ的名称____。
(2)滤渣的成分为_____。
(3)请写出溶液A中反应的离子方程式___。在标准状况下,转移0.4NA个电子时,通入的空气体积为_____。
(4)测定废料中硫酸铜的质量分数:称取ag废料样品,将操作I得到的滤渣用足量的稀硫酸溶解、过滤、洗涤、干燥,称得固体的质量为b g,则废料中硫酸铜的质量分数____(写出表达式)。
(5)向工业废料溶液中加入足量的酸性高锰酸钾,写出有关的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. 乙醇和丙三醇互为同系物
B. 环己烯(![]() )分子中的所有碳原子共面
)分子中的所有碳原子共面
C. 分子式为C5H10O2,且属于羧酸的同分异构体共有9种(不考虑立体异构)
D. 二环己烷( ![]() )的二氯代物有7种结构(不考虑立体异构)
)的二氯代物有7种结构(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃、101 kPa时,强酸与强碱的稀溶液中发生中和反应的中和热为57.3 kJ·mol-1,则下列描述正确的是
A. KOH(aq)+![]() H2SO4(aq)===
H2SO4(aq)===![]() K2SO4(aq)+H2O(1) ΔH=-57.3 kJ·mol-1
K2SO4(aq)+H2O(1) ΔH=-57.3 kJ·mol-1
B. NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(1) ΔH=+57.3 kJ·mol-1
C. H2SO4和Ca(OH)2反应的中和热为ΔH=2×(-57.3) kJ·mol-1
D. 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com