

| t1��t2 | t2��t3 | t3��t4 | t4��t5 | t5��t6 |
| K1 | K2 | K3 | K4 | K5 |
���� ��1������v=$\frac{��c}{��t}$����v��C����
��2����3��ͼ���������ֲ�ͬ�����Ӱ�컯ѧ��ƽ�⣬��Ӱ��ƽ��������У�Ũ�ȡ��¶ȡ�ѹǿ��������
t3��t4��t4��t5������ƽ���Dz��ƶ��ģ���ֻ����ѹǿ�ʹ���Ӱ��ģ����Ӧ���ƶϸ÷�ӦΪ������仯�ķ�Ӧ��
t3��t4��ƽ���ԭƽ�������Ҫ�죬��t4��t5�������ֱ�������ǰ��Ӧ�ǼӴ�������Ϊ����ֻ����һ�Σ�t4��t5��Ϊ��ѹ��
��Ӧ���Ũ�Ƚ��ͣ��������Ũ�������ͼһ��֪��AΪ��Ӧ�CΪ�����A�ı仯Ϊ0.2mol/L��C�ı仯��Ϊ0.3mol/L�������ڸ÷�ӦΪ������仯�ķ�Ӧ������BΪ��Ӧ����ݻ�ѧ��Ӧ������֮�ȵ��ڻ�ѧ����ʽǰ�ļ���ϵ���ȣ�д���÷�Ӧ�ķ���ʽΪ2A��g��+B��g��?3C��g������ʼ2molA����Ӧ��Ũ��Ϊ1mol/L�������Ӧ��2L��
t5-t6 ��Ϊ�����¶ȣ�v�����������棩��ƽ��������Ӧ�����ƶ��������¶�ƽ�������ȷ����ƶ�������ƽ�ⳣ����ƽ���ƶ����K1��K2��K3��K4��K5֮��Ĺ�ϵ��
��4��Ҫ�ﵽt1ʱ��ͬ����ƽ�⣬ӦΪ��ȫ��Чƽ�⣬���������ԭƽ����ȣ�
��� �⣺��1��15min�ڣ���CŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊv��C��=$\frac{0.6mol/L-0.3mol/L}{15min}$=0.02 mol/��L•min�����ʴ�Ϊ��0.02 mol/��L•min����
��2��t3��t4��t4��t5������ƽ���Dz��ƶ��ģ���ֻ����ѹǿ�ʹ���Ӱ��ģ����Ӧ���ƶϸ÷�ӦΪ������仯�ķ�Ӧ��
t3��t4��ƽ���ԭƽ�������Ҫ�죬��t4��t5�������ֱ�������ǰ��Ӧ�ǼӴ�������Ϊ����ֻ����һ�Σ�t4��t5��Ϊ��ѹ��
��Ӧ���Ũ�Ƚ��ͣ��������Ũ�������ͼһ��֪��AΪ��Ӧ�CΪ�����A�ı仯Ϊ0.2mol/L��C�ı仯��Ϊ0.3mol/L�������ڸ÷�ӦΪ������仯�ķ�Ӧ������BΪ��Ӧ����ݻ�ѧ��Ӧ������֮�ȵ��ڻ�ѧ����ʽǰ�ļ���ϵ���ȣ�
�÷�Ӧ�ķ���ʽΪ2A��g��+B��g��?3C��g�������ԣ���c��B��=$\frac{1}{2}$��n��A��=$\frac{1}{2}$��0.2mol/L=0.1mol/L����ʼ2molA����Ӧ��Ũ��Ϊ1mol/L�������Ӧ��$\frac{2mol}{1mol/L}$=2L����B����ʼ���ʵ���Ϊn��B��=��0.1mol/L+0.4mol/L����2L=1mol��
t1-t2�Σ�����ƽ��״̬��c��A��ƽ��=0.8mol/L��c��B��ƽ��=0.4mol/L��c��C��ƽ��=0.6mol/L��
K1=$\frac{{c}^{3}��C��}{{c}^{2}��A��•c��B��}$=$\frac{0��{6}^{3}}{0��{8}^{2}��0.4}$=0.84��
t2-t3�Σ�Ϊ�ı�Ũ�ȣ�ƽ���ƶ���ƽ�ⳣ�����䣬K2=0.84��
t3-t4�Σ�ʹ�ô������ӿ췴Ӧ��ƽ�ⳣ�����䣬K3=0.84��
t4-t5�Σ�Ϊ����ѹǿ����Ӧ���ʽ��ͣ�ƽ�ⲻ�ƶ���ƽ�ⳣ�����䣬K4=0.84��
t5-t6�Σ�Ϊ�����¶ȣ�ƽ��������Ӧ�����ƶ���ƽ�ⳣ������ K1=K2=K3=K4��K5��
�ʴ�Ϊ����Сѹǿ��1.0mol��0.84��K1=K2=K3=K4��K5��
��3�����ݷ���ʽ���㣬��A�����ʵ������仯��0.01mol�����˹����������������Ƚ�������Ϊa kJ����Ӧ2molAʱ����������200akJ������ͼ���֪��t5��t6��ӦΪ�����¶ȣ�����Ӧ���ʴ����淴Ӧ���ʣ�ƽ��������Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ�������Ȼ�ѧ����ʽΪ2A��g��+B��g��?3C��g����H=+200a kJ/mol��
�ʴ�Ϊ��2A��g��+B��g��?3C��g����H=+200a kJ/mol��
��4����Ӧ�ķ���ʽΪ2A��g��+B��g��?3C��g�������ݷ���ʽ���㣬��ʼʱ����C��������ת��ΪA��B����A�����ʵ���Ϊ2mol+$\frac{2}{3}$��0.6mol=2.4mol��B�����ʵ���Ϊ1mol+$\frac{1}{3}$��0.6mol=1.2mol������ͬ�����£�����ʼʱ�����м���a mol A��b mol B��c mol C��Ҫ�ﵽt1ʱ��ͬ����ƽ�⣬���������ʵ����ʵ��������������ԭƽ����ȣ�
������a+$\frac{2}{3}$c=2.4��b+$\frac{1}{3}$c=1.2��
�ʴ�Ϊ��a+$\frac{2}{3}$c=2.4��b+$\frac{1}{3}$c=1.2��
���� ������ͼ�����ʽ����Ӱ�컯ѧ��Ӧ�����Լ���ѧƽ���ƶ������أ���Ŀ�Ѷ��еȣ�ע���Чƽ�����⣬Ϊ������ѵ㣬Ҳ���״��㣮


 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��NH2-NH-NH-NH-NH-NH2��
��NH2-NH-NH-NH-NH-NH2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2CO3��Һ��NaHCO3��������������NaOH��Һ | |
| B�� | NaHCO3��Һ��Na2CO3����ͨ�������CO2���� | |
| C�� | CO2���壨HCl���壩��ͨ�����͵�Na2CO3��Һ | |
| D�� | SiO2��H2SiO3�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��m1��m2ʱ����Һa�е�������ֻ��1�� | |
| B�� | ������ɫ��Һ�����ӷ���ʽΪCu+2Fe3+�TCu2++2Fe2+ | |
| C�� | Ҫȷ����������Ƿ���Al����ȡA��������ϡ���� | |
| D�� | ��m2-m3=2.96 gʱ��Fe3O4����������Ϊ2.32 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/���棩 | 700 | 80 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
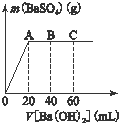 �ڳ����£�ijˮ��ҺM�У�
�ڳ����£�ijˮ��ҺM�У��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
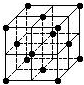
| A�� | C60Ħ��������720 | |
| B�� | C60�������Ӿ��� | |
| C�� | ��C60��������14��C60���� | |
| D�� | ÿ��C60������Χ������������Ⱦ����C60������12�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1molH2O������Ϊ18g/mol | |
| B�� | O2 ��Ħ������Ϊ32g | |
| C�� | 2mol NaOH ����1 Lˮ�������Һ��Ũ��Ϊ2mol/L | |
| D�� | 6.02��1023��CO���ӵ�����ԼΪ28g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 A��B��C�ǵ��ʣ�����A�dz����Ļ��ý�����B��C������ɫ���壬�����Ⱥ�����ɼף��������ʼ��ת����ϵ��ͼ��
A��B��C�ǵ��ʣ�����A�dz����Ļ��ý�����B��C������ɫ���壬�����Ⱥ�����ɼף��������ʼ��ת����ϵ��ͼ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com