
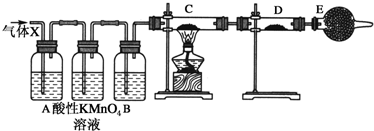
分析 (1)甲同学实验中涉及的反应是电石与水的反应,乙炔与溴水的反应,电石为碳化钙,与水反应生成乙炔和氢氧化钙,乙炔含有碳碳三键,能够与溴发生加成反应;
(2)生成的乙炔中混有硫化氢气体,可与溴水发生氧化还原反应而使溴水褪色;
(3)电石中含有硫化物,与水反应生成硫化氢气体,硫化氢与溴反应生成硫和溴化氢.
解答 解:(1)碳化钙能与水反应生成乙炔和水,反应方程式为CaC2+2H2O→Ca(OH)2+C2H2↑,乙炔具有不饱和键,能与溴水发生加成反应而使溴水褪色,反应方程式为:CH≡CH+Br2→CH(Br)═CH(Br)、CH≡CH+2Br2→CHBr2-CHBr2,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;CH≡CH+Br2→CH(Br)═CH(Br)或CH≡CH+2Br2→CH(Br)2-CH(Br)2;
(2)根据“乙同学发现甲同学实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还有可能含有少量还原性的杂质气体”,因此可得出“使溴水褪色的物质,未必是乙炔;使溴水褪色的反应,未必是加成反应”的结论,故甲同学设计的实验不能证明乙炔与溴水发生了加成反应,可能生成的乙炔中混有硫化氢气体,可与溴水发生氧化还原反应而使溴水褪色,反应方程式为Br2+H2S═S↓+2HBr,
故答案为:不能;ac;
(3)根据褪色后的溶液里有少许淡黄色浑浊,可推知是硫,说明乙炔气体中含有硫化氢杂质,所发生反应的化学方程式是Br2+H2S═S↓+2HBr,
故答案为:H2S;Br2+H2S═S↓+2HBr.
点评 本题以乙炔的实验室制法为载体考查了乙炔的性质,明确制备乙炔的原理和乙炔的结构特点是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 酸性KI淀粉溶液久置后变蓝 4I-+O2+2H2O═2I2+4OH- | |
| C. | 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞SiO2+2OH-═SiO32-+H2O | |
| D. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 02是氧化剂,PtF6是还原剂 | |
| B. | 02 (PtF6)中氧元素的化合价为+1 | |
| C. | 02( PtF6)中不存在共价键 | |
| D. | 每生成1 mol O2 (PtF6)则转移1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
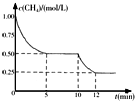 密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )
密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )| A. | 0~5 min内,v(H2)=0.1 mol/(L•min) | |
| B. | 10 min时改变的外界条件可能是升高温度 | |
| C. | 恒温下,缩小容器体积,平衡后c(H2)减小 | |
| D. | 12 min时反应达平衡的本质原因是气体总质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | l mol H20最多可形成氢键数目为2NA | |
| B. | 标准状况下,11.2 L甲醛所含的σ键数目为2NA | |
| C. | 常温下,46 g N02所含分子数目为NA | |
| D. | pH=l的硫酸中所含S042-的数目为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com