
����Ŀ���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״����ڹ̶������н��У���2H2��g��+CO��g��CH3OH��g��
��1��������������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K��
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ٸ÷�Ӧ���ر��S0 �� �����������=�������÷�Ӧ��������»���£����������Է����У�
��Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��������ţ���
a������ b��������� c������CO��Ũ�� d������H2��ѹ
e��������������ѹ f��������״�
��2����ͼ��ʾ���¶ȷֱ�ΪT1��T2ʱ��ƽ����ϵ��H2�����������ѹǿ�仯���ߣ�A��C����ķ�Ӧ����AC�����������=����������ͬ����A��C����Ļ�ѧƽ�ⳣ��AC����״̬B��״̬A���ɲ����ķ���������¡����¡����� 
���𰸡�
��1���������£�df
��2������=������
���������⣺��1����2H2��g��+CO��g��CH3OH��g����Ӧ��������ʵ������٣����ԡ�S��0���ɱ������ݿ�֪�¶����ߣ�Kֵ��С��˵��ƽ�����淴Ӧ�����ƶ����淴ӦΪ���ȷ�Ӧ������Ӧ��Ϊ���ȷ�Ӧ��H��0���ɡ�G=��H��T��S��֪����Ӧ�ڵ������������Է����У����Դ��ǣ��������£���a������ƽ�������ƶ�����CO��ת���ʼ�С���ʴ���
b���������ƽ�ⲻ�ƶ�����CO��ת���ʲ��䣬�ʴ���
c������CO��Ũ�ȣ�ƽ����Ȼ�����ƶ�����CO��ת���ʼ�С���ʴ���
d������H2��ѹ��ƽ�������ƶ���CO��ת������ߣ�����ȷ��
e��������������ѹ��ƽ�ⲻ�ƶ�����CO��ת���ʲ��䣬�ʴ���
f��������״���ƽ�������ƶ���CO��ת������ߣ�����ȷ��
��ѡ��d f����2����ΪѹǿԽ��Ӧ����Խ������A��C����ķ�Ӧ����A��C����ѧƽ�ⳣ�������¶��йأ�����A��C����Ļ�ѧƽ�ⳣ��A=C����״̬B��״̬A���ɲ������µķ��������Դ��ǣ�����=�����£�
�����㾫����������Ҫ�����˻�ѧƽ��״̬���ʼ����������֪ʶ�㣬��Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч��������ȷ�����⣮


 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д� �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ����һ�����Ϊ2L�������У�A������B���巴Ӧ����C���壬��Ӧ������A��B��CŨ�ȱ仯��ͼ��ʾ�� 
��1��д���÷�Ӧ�ķ���ʽ����
��2��0��4�����ڼ䣬B��ƽ����Ӧ����Ϊ����
��3������ƽ��ʱB��ת����Ϊ����
��4����֪��K��300�棩��K��350�棩���÷�Ӧ���ȷ�Ӧ��
��5�����������£����д�ʩ����ʹ ![]() ���͵���
���͵���
a�����뺤�� b�������¶� c��ʹ�ô��� d���ٳ���2.4mol A��1.6mol B��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�װ��ͼ�������У�����ȷ���ǣ� �� 
A.��װ�âپ���ͭ����a��Ϊ��ͭ���������ҺΪCuSO4��Һ
B.��װ�âٽ��е�ƣ��Ƽ�����b����
C.װ�âڵ��ܷ�Ӧ�ǣ�Cu+2Fe3+�TCu2++2Fe2+
D.װ�â��е���������û����ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʣ�ǰ��Ϊǿ����ʣ�����Ϊ�ǵ���ʵ��ǣ� ��
A.���ᡢ����
B.���Լء���������
C.�Ȼ��⡢���ʯ
D.�Ȼ��ơ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ��һ��ʳ�����ϣ��ṹ��ʽ��ͼ���й�����ϩ�ķ�����ȷ���ǣ� �� ![]()
A.����ϩ��һ�ȴ�����8��
B.����ϩ�� ![]() ��Ϊͬ���칹��
��Ϊͬ���칹��
C.����ϩ�ķ��������е�̼ԭ�ӿ�����ͬһ��ƽ����
D.һ�������£�����ϩ���Է����ӳɡ�ȡ�����������Ӿۡ������ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������д�����ǣ�������
A.����ʱ����������ĩ��Ӧ�����������ֽ��
B.����ʱ��Ӧʹ�¶ȼ�ˮ����������ƿ��֧�ܿڴ�
C.��Һʱ����Һ©�����²�Һ����¿ڷų����ϲ�Һ����Ͽڵ���
D.����������ʱ������ֱ�ӳ�����Ҫ����ֽƬ�ϳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ҫ����к��ȵIJⶨ��
��1��ʵ�����ϱ����ձ�����С�����ձ�������ĭ���ϡ���ĭ���ϰ塢��ͷ�ιܡ����β�������0.5molL��1 ���ᡢ0.55molL��1NaOH��Һ����ȱ�ٵ�ʵ�鲣����Ʒ���� ��
��2��ʵ�����ܷ��û���ͭ˿��������滷�β��������������ܡ�����
��3�����Ǽ�¼��ʵ���������£���֪��Q=Cm��t2��t1������Ӧ����Һ�ı�����CΪ4.18kJ����1kg��1 �� �����ʵ��ܶȾ�Ϊ1gcm��3 �� �ټ�������±���������С�����һλ��
��� | ʵ����Ʒ | ��Һ�¶� | �к��ȡ�H | ||
t1 | t2 | ||||
�� | 50mL0.55molL��1NaOH | 50mL0.55molL��1HCl | 20�� | 23.3�� | |
�� | 50mL0.55molL��1NaOH | 50mL0.55molL��1HCl | 20�� | 23.3�� | |
�ڸ���ʵ����д��NaOH��Һ��HCl��Һ��Ӧ���Ȼ�ѧ����ʽ��
��4������KOH����NaOH���Բⶨ�������С����ޡ���Ӱ�죻���ô������HCl��ʵ�飬�ⶨ���õ��к��ȵ���ֵ��������С������Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֬����Ҫ��Ӫ�����ʡ�ij��Ȼ��֬A�ɷ������з�Ӧ��

��֪��A�ķ���ʽΪC57H106O6��1 mol����Ȼ��֬A����Ӧ�ٿɵõ�1 mol D��1 mol������֬����B��2 molֱ������֬����C�����ⶨB����Է�������Ϊ280��ԭ�Ӹ�����ΪC��H��O��9��16��1��
(1)д��B�ķ���ʽ��______________��
(2)д����Ӧ�ٵķ�Ӧ���ͣ�______________��C������(���׳�)��______________��
(3)���գ�����ý����ڡ��⻯��Σ������ɱ������ı���������Ȼ����Ӧ��Ϊ��Ȼ��֬���⻯���̡������й�˵������ȷ����______________��
a���⻯���ֳ��������ͣ�ͨ���ֽ�Ӳ����
b��ֲ���;����⻯��������������Ʒ��ʽ֬��������������������⻯�ͣ�������Ѫ�ܶ���������Ѫ�ܼ���
c���⻯�͵��Ʊ�ԭ�����ڼ���ֲ����ʱ���������������ͨ��������ʹҺ̬��֬��Ϊ���̬���̬��֬
d����֬���⻯����֬�����������ڼӳɷ�Ӧ��
(4)D�����������Ʒ�Ӧ�Ļ�ѧ����ʽ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ��ʯī���缫�����ϡ��Na2SO4��Һ��װ�ã�ͨ�����ʯī�缫A��B�����ֱ�μ�һ��ʯ����Һ�������й�������ȷ���ǣ� �� 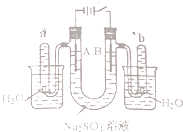
A.�ݳ�����������A�缫��С��B�缫��
B.һ�缫�ݳ���ζ���壬��һ�缫�ݳ��̼�����ζ����
C.A�缫�����ʺ�ɫ��B�缫��������ɫ
D.���һ��ʱ���ȫ�����Һת�Ƶ�ͬһ�ձ��У���ֽ�����ܽ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com