
| A. | 食物储存在冰箱里 | |
| B. | 铁制品表面刷油漆 | |
| C. | 用5%H2SO4溶液代替25%H2SO4溶液与锌粒反应 | |
| D. | 用过氧化氢溶液制氧气时添加少量二氧化锰粉末 |
科目:高中化学 来源: 题型:选择题
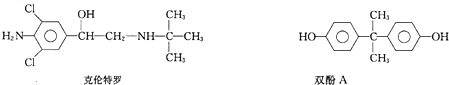
| A. | 它们都含有手性碳原子 | |
| B. | 它们都能在一定条件下与溴、氢氧化钠发生反应 | |
| C. | 它们遇三氯化铁溶液都能显紫色 | |
| D. | 它们都能发生消去反应、加成反应、酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6+m | B. | 6-m | C. | 3+m | D. | 3-m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中,有放热反应也有吸热反应 | |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| C. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应是吸热反应 | |
| D. | 化学反应中能量变化的大小与反应物的质量多少无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA | |
| B. | 0.1mol Na2SO4溶液中,含有SO42-数为0.1NA | |
| C. | 46gNO2和N2O4混合气体中,含有氧原子总数为3NA | |
| D. | 0.5L 1mol/LNaCl溶液中含有的钠离子浓度1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
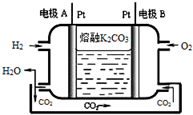 Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题: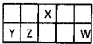
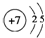 .
.| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com