
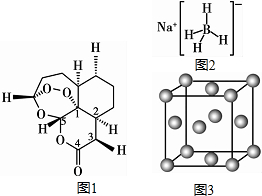
 现有H、C、B、0、N、Na、Cu等七种元素,可形成多种物质.2015年10月中国药学家屠呦呦因发现青蒿素(含H、C、O元素)而获得诺贝尔生理医学奖,青蒿素( C15H22O5)的结构
现有H、C、B、0、N、Na、Cu等七种元素,可形成多种物质.2015年10月中国药学家屠呦呦因发现青蒿素(含H、C、O元素)而获得诺贝尔生理医学奖,青蒿素( C15H22O5)的结构分析 (1)组成青蒿素的三种元素为H、C、O,根据电负性的递变规律判断电负性的大小顺序;在基态O原子中,核外有8的电子,其中有3个轨道有成对电子;
(2)a.青蒿素中存在O-O键、C-C键,为非极性键,C-O、C-H键为极性键;
b.含有饱和碳原子,具有烷烃的结构;
c.C=O键含有π键;
(3)N02-与SO2互为等电子体,二氧硫的分子空间构型为V型;CO32-中C价层电子对数=$\frac{4+0×3+2}{2}$=3,C杂化类型为sp2;
(4)C、N、O分别与H形成的CH4、NH3、H20中,水是液态,另外两种为气态,氨分子、水分子之间有氢键,据此判断;
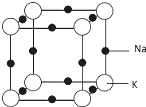
(5)根据图2所示,NaBH4结构中存在着离子键 和共价键;
(6)该晶胞中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,根据ρ=$\frac{4×\frac{M}{{N}_{A}}}{V}$计算阿伏伽德罗常数.
解答 解:(1)组成青蒿素的三种元素为H、C、O,元素的非金属性越强,电负性越强,非金属性:O>C>H,则H、C、O三种元素的电负性由大到小的顺序是O>C>H,;在基态O原子中,核外有8的电子,其中有3个轨道有成对电子,则核外存在3对自旋相反的电子,
故答案为:O>C>H;3;
(2)a.青蒿素中存在O-O键、C-C键,为非极性键,C-O、C-H键为极性键,故a正确;
b.含有饱和碳原子,具有烷烃的结构,则所有碳原子不处于同一平面,故b错误;
c.C=O键含有π键,故c错误;
故答案为:a;
(3)N02-与SO2互为等电子体,二氧硫的分子空间构型为V型;CO32-中C价层电子对数=$\frac{4+0×3+2}{2}$=3,C杂化类型为sp2,
故答案为:V型;sp2;
(4)C、N、O分别与H形成的CH4、NH3、H20中,水是液态,另外两种为气态,氨分子、水分子之间有氢键,所以CH4、NH3、H20沸点由高到底的顺序为H20>NH3>CH4,
故答案为:H20>NH3>CH4;
(5)根据图2所示,钠离子与硼氢根离子之间是离子键,硼氢根离子内部硼原子与氢原子之间是共价键,所以NaBH4结构中存在着离子键 和共价键,
故答案为:离子键 和共价键;
(6)该晶胞中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,根据ρ=$\frac{4×\frac{M}{{N}_{A}}}{V}$知,NA=$\frac{4M}{ρV}$=$\frac{64×4}{a{\;}^{3}×10{\;}^{-30}×b}$mol-1=$\frac{256×10{\;}^{30}}{{a}^{3}b}$mol-1,
故答案为:$\frac{256×10{\;}^{30}}{{a}^{3}b}$.
点评 本题考查物质结构和性质,涉及晶胞计算、氢键、微粒空间构型判断、原子杂化方式判断等知识点,明确基本理论基本原理是解本题关键,侧重考查学生对基本知识的灵活运用,难点是晶胞计算.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何晶体中,若含有阳离子就一定有阴离子 | |
| B. | 原子晶体中只含有共价键 | |
| C. | 原子晶体的熔点一定比金属晶体的高 | |
| D. | 分子晶体中只含有范德华力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②③⑤ | B. | ④①②③⑤ | C. | ⑤③②①④ | D. | ④①③⑤② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;④HCHO等,其中碳原子采取sp2杂化的分子有①③④(填序号);HCHO分子的空间构型为平面三角形.
;④HCHO等,其中碳原子采取sp2杂化的分子有①③④(填序号);HCHO分子的空间构型为平面三角形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com