某无色溶液,由Na+、Ba2+、Al3+、Cl-、MnO4-、CO32-、NO3-中的若干种组成.,现取两份100mL溶液进行如下实验:
①第一份小心蒸发得溶质3.08g;
②第二份加足量AgNO3溶液后,得干燥沉淀5.63g,向沉淀中加入足量盐酸,生成标准状况下气体0.224L.
根据上述实验回答下列问题:
(1)第二份溶液所得沉淀的成分是______,其物质的量分别是______.
(2)写出步骤②中所发生的所有反应的离子方程式______.
(3)一定存在的离子是______,其浓度分别是______.
【答案】
分析:溶液无色,则一定不存在MnO
4-,第二份加足量AgNO
3溶液后,得干燥沉淀5.63g,向沉淀中加入足量盐酸,生成标准状况下气体0.224L,则说明原溶液中含有CO
32-,
则一定不存在Ba
2+、Al
3+,根据溶液电中性原则,则一定存在Na
+,以此来确定溶液的组成.
解答:解:溶液无色,则一定不存在MnO
4-,
第二份加足量AgNO
3溶液后,得干燥沉淀5.63g,向沉淀中加入足量盐酸,生成标准状况下气体0.224L,
则说明原溶液中含有CO
32-,且n(CO
32-)=
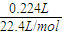
=0.01mol,
则m(Ag
2CO
3)=0.01mol×276g/mol=2.76g<5.63g,
所以:溶液中还有Cl
-,n(Cl
-)=n(AgCl)=
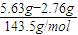
=0.02mol,
步骤②中所发生的所有反应的离子方程式有:2Ag
++CO
32-=Ag
2CO
3↓,
Ag
++Cl
-=AgCl↓,
Ag
2CO
3+2H
++2Cl
-=2AgCl+H
2O+CO
2↑.
所以原溶液中含有n(NaCl)=0.02mol,n(Na
2CO
3)=0.01mol,
m(NaCl)=0.02mol×58.5g/mol=1.17g,
n(Na
2CO
3)=0.01mol×106g/mol=1.06g.
则有:1.17g+1.06g=2.23g<3.08g,
所以溶液中还应含有NO
3-,
则:n(NO
3-)=n(NaNO
3)=
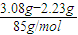
=0.01mol,
n(Na
+)=0.01mol×2+0.02mol+0.01mol=0.05mol,
故答案为:(1)AgCl、Ag
2CO
3;0.02mol、0.01mol;
(2)2Ag
++CO
32-=Ag
2CO
3↓,Ag
++Cl
-=AgCl↓,Ag
2CO
3+2H
++2Cl
-=2AgCl+H
2O+CO
2↑;
(3)Na
+、Cl
-、CO
32-、NO
3-;Na
+(0.5mol/L)、Cl
-(0.2mol/L)、CO
32-(0.1mol/L)、NO
3-(0.1mol/L).
点评:本题注重的不仅仅是离子之间的反应,更应注重在题设条件下离子之间的隐含反应,如过量的试剂带来的反应,如离子反应后新生成离子的反应,要把离子反应与实验现象“瞻前顾后”结合起来分析.

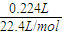 =0.01mol,
=0.01mol,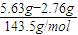 =0.02mol,
=0.02mol,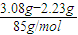 =0.01mol,
=0.01mol,
