
| A. | -5.56×104 kJ•mol-1 | B. | 5.56×104 kJ•mol-1 | ||
| C. | 5.56×104 kJ | D. | -5.56×104 kJ |
分析 燃烧热是在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,甲烷的燃烧热890.3kJ•mol-1,即1molCH4在25℃,101kPa时充分燃烧生成液态水放出的热量为890.3kJ,先求出1kg甲烷的物质的量,然后计算出1kg甲烷完全燃烧放出的热量.
解答 解:1kg甲烷的物质的量为:n=$\frac{1000g}{16g/mol}$=62.5mol,甲烷的燃烧热△H=-890.3kJ•mol-1,说明1molCH4在25℃,101kPa时充分燃烧生成液态水放出的热量为890.3kJ,则62.5mol甲烷在25℃,101kPa时充分燃烧生成液态水放出的热量为:890.3kJ•mol-1×62.5mol=5.56×104kJ,
故选C
点评 本题考查了燃烧热的定义及反应热的有关计算,题目难度不大,明确燃烧热的概念为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | v(CO2)=v(CO) | B. | 容器中总压强不变 | ||
| C. | 容器中混合气体的密度不变 | D. | 各组分浓度不再随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉在空气中易变质,所以应密封保存 | |
| B. | 工业上可用铁质容器存放浓硫酸 | |
| C. | 液氯可储存在钢瓶中,便于运输和使用 | |
| D. | 硅酸钠的水溶液俗称“水玻璃”,可保存在带玻璃塞的细口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用带橡皮塞的棕色试剂瓶存放浓硝酸 | |
| B. | 容量瓶、分液漏斗使用前均需检查是否漏水 | |
| C. | 分液漏斗分液时,必须先将下层液体从下口放出,再将上层液体从上口倒出 | |
| D. | 蒸馏时,需将温度计的水银球没入液面以下且不接触烧瓶壁 | |
| E. | 氨气喷泉实验时,收集气体的烧瓶必须干燥 | |
| F. | 用玻璃棒蘸取待测液,点在润湿的pH试纸上测定其pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下硫的氧化物都是气体,通入水中都形成强酸 | |
| B. | 将FeCl3滴入饱和H2S溶液中,溶液的pH降低 | |
| C. | 将CO2通入CaSO4溶液中,无明显现象 | |
| D. | 充分利用含硫矿物,既可实现资源的有效利用,还可减轻酸雨污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| B. | 2.24 L CO2中含有的原子数为0.3×6.02×1023 | |
| C. | 200 mL 5 mol•L-1 Na2CO3溶液中,含6.02×1023个CO32- | |
| D. | 4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
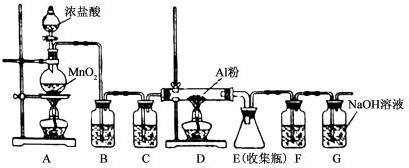
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com