
【题目】I. 现有一组物质的熔点(℃)数据,据此回答下列问题:
HF:-83 | HCl:-115 | HBr:-89 | HI:-51 |
(1)HF熔点反常是由于______________。这组物质中共价键的键能最大的是_____。
II.按要求回答下列问题。
(2)CS2气化时克服的粒子间作用是__________,1mol CS2中含有___mol σ键,含有___mol π键。
(3)HCHO分子中C原子轨道的杂化类型为______。
【答案】HF分子间能形成氢键,其熔化时需要消耗的能量更多 HF 范德华力 2 2 sp2
【解析】
(1)熔点是物理性质,用分子间作用力解释;键能是化学键的参数之一,用分子内原子间作用力解释;
(2)CS2属于分子晶体,气化时克服的粒子间作用是范德华力;二硫化碳中心原子碳形成四个共价键,两个σ键,两个π键;
(3)HCHO分子中心原子C的价层电子对数为3+![]() =3,由此确定碳的杂化方式。
=3,由此确定碳的杂化方式。
(1)因F的非金属性很强,在HF分子之间存在氢键,HCl、HBr、HI分子之间不存在氢键,HF熔点反常是由于HF分子间能形成氢键,其熔化时需要消耗的能量更多。从F到I,电子层数增大,原子半径增大,与氢原子的作用力减小,键能逐渐减小,这组物质中共价键的键能最大的是HF。故答案为:HF分子间能形成氢键,其熔化时需要消耗的能量更多;HF;
(2)CS2属于分子晶体,气化时克服的粒子间作用是范德华力;二硫化碳中一个硫原子用两个共价键和碳原子相连,两个共价键中有一个是σ键,另一个是π键,所以一个二硫化碳分子中有两个σ键,两个π键,1mol CS2中含有2mol σ键,含有2mol π键。故答案为:范德华力;2;2;
(3)HCHO分子中心原子C的价层电子对数为3+![]() =3,C原子轨道的杂化类型为sp2。故答案为:sp2。
=3,C原子轨道的杂化类型为sp2。故答案为:sp2。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸的反应B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与CO2的反应D.甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298 K时,合成氨反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
A. 一定小于92.0 kJ B. 一定大于92.0 kJ
C. 一定等于92.0 kJ D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石![]() 碳化硅
碳化硅![]() 晶体硅
晶体硅
C.晶格能由大到小:NaF>NaCl>NaBr>NaI
D.熔点由高到低:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分反应的产物已略去)。A只含两种元素,摩尔质量为72g·mol1。B是无色气体,其水溶液是常见的酸,C是常见金属,E的组成元素与水相同,其水溶液常用于实验室制氧气,H的俗名是熟石灰,J为红褐色固体。

(1)A的化学式为___。
(2)D的电子式为___。
(3)写出反应③的离子方程式:___。
(4)写出反应④的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置,A、B和C是中学常见的化合物,回答问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)上述所列元素中,最高价氧化物的水化物的酸性最强的是________(填化学式)。
(2)②元素最高正价与④元素形成的化合物的电子式是__________。
(3)⑤⑨两种元素形成氢化物的水溶液的酸性由弱到强的顺序为________(用化学式表示)。
(4)从④⑥两种元素形成的化合物与④⑧两种元素形成的化合物的混合物中分离提纯④⑧两种元素形成的化合物,可加入上表中________(用元素符号表示)两种元素形成的化合物的水溶液后,再过滤洗涤。
(5)③元素的气态氢化物与其最高价氧化物的水化物反应生成的物质为________(用化学式表示),该物质所含化学键类型有________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体。合成肉桂酸甲酯的工业流程如下图所示:
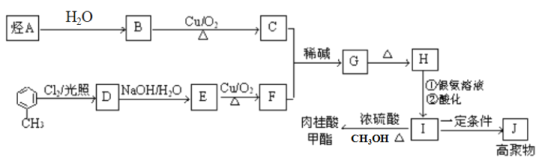
已知:I. 烃A在标准状况下的密度为1.25 g/L。
II.醛与醛能发生反应,原理如下:
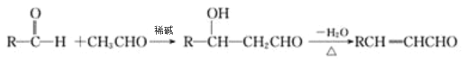
请回答:
(1)化合物H中的官能团为_____________________。
(2)肉桂酸甲酯的结构简式为_________________,J的结构简式为____________。
(3)G→H的反应类型为________。
(4)写出反应B→C的化学方程式___________________________。
(5)符合下列条件的I的同分异构体共有5种。写出另两种同分异构体的结构简式:
A.能发生水解反应
B.与银氨溶液作用出现光亮的银镜
C.能与溴发生加成
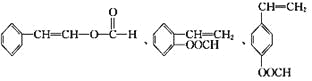 、_________、__________
、_________、__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L的密闭容器中通入2mol NH3,在一定温度下发生下列反应:2NH3![]() N2+3H2,达到平衡时,容器内N2的百分含量为a%。若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内
N2+3H2,达到平衡时,容器内N2的百分含量为a%。若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内![]() 的百分含量也为a%的是( )
的百分含量也为a%的是( )
A.3mol H2+2mol N2B.2mol NH3+1mol N2
C.3mol N2+1mol H2D.0.lmol NH3+0.95mol N2+2.85mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯![]() 是广泛用于电子行业的强磁性材料.
是广泛用于电子行业的强磁性材料.![]() 为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于
为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于![]() 开始分解。
开始分解。
Ⅰ![]() 实验室以
实验室以![]() 为原料制备
为原料制备![]()
![]() 制备
制备![]() 溶液:
溶液:
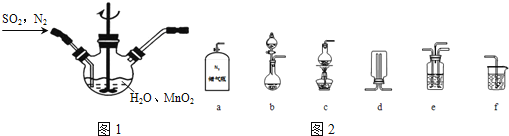
![]() 主要反应装置如图1,缓缓通入经
主要反应装置如图1,缓缓通入经![]() 稀释的
稀释的![]() 气体,发生反应
气体,发生反应![]() ,下列措施中,目的是加快化学反应速率的是______
,下列措施中,目的是加快化学反应速率的是______![]() 填标号
填标号![]() 。
。
A.![]() 加入前先研磨
加入前先研磨![]() 搅拌
搅拌![]() 提高混合气中
提高混合气中![]() 比例
比例
![]() 已知实验室制取
已知实验室制取![]() 的原理是
的原理是![]() 浓
浓![]()
![]()
![]() 选择如图2所示部分装置与图装1置相连制备
选择如图2所示部分装置与图装1置相连制备![]() 溶液,应选择的装置有______
溶液,应选择的装置有______![]() 填标号
填标号![]() .
.
![]() 若用空气代替
若用空气代替![]() 进行实验,缺点是______
进行实验,缺点是______![]() 酸性环境下
酸性环境下![]() 不易被氧化
不易被氧化![]()
![]() 制备
制备![]() 固体:
固体:
实验步骤:![]() 向
向![]() 溶液中边搅拌边加入饱和
溶液中边搅拌边加入饱和![]() 溶液生成
溶液生成![]() 沉淀,反应结束后过滤;
沉淀,反应结束后过滤;![]() ;
;![]() 在
在![]() 下烘干得到纯净干燥的
下烘干得到纯净干燥的![]() 固体。
固体。
步骤![]() 需要用到的试剂有______。
需要用到的试剂有______。
Ⅱ![]() 设计实验方案
设计实验方案
![]() 利用沉淀转化的方法证明
利用沉淀转化的方法证明![]() :______
:______![]() 已知
已知![]() 为难溶于水的浅绿色固体
为难溶于水的浅绿色固体![]()
![]() 证明
证明![]() 的第二步电离不完全:______
的第二步电离不完全:______![]() 查阅资料表明
查阅资料表明![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com