
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
⑴ 第1步:灼烧。操作是将足量海带灼烧成灰烬,该过程中将使用到的硅酸盐质实验仪器有_________________(填代号,限填3项)
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三角架
E.泥三角 F.酒精灯 G.烧杯 H.量筒
⑵ 第2步:I— 溶液的获取。操作是____________________________________________。
⑶ 第3步:氧化。 操作是依次加入合适的试剂,下列氧化剂最好选用_________(填代号),
A.浓硫酸 B.新制氯水 C.KMnO4溶液 D.H2O2
理由是____________________________________________________________。
⑷ 第4步:碘单质的检验。 操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
【答案】
(1)B E F
(2)将灰烬转移到烧杯中,加适量蒸馏水,用玻棒充分搅抖,煮沸,过滤
(3)D
过氧化氢是绿色氧化剂,在氧化过程中不引进杂质、不产生污染(不会进一步氧化单质碘)
【解析】本题主要考查对验证某一成分的实验设计方案的理解,涉及实验仪器的材料性能、药品试剂的选择、实验操作步骤的要领等内容。题目设计新颖、考查角度独特,体现出了活用教材、注重能力、利于创新的教学理念。根据实验目的,明确实验原理,掌握各步实验操作要领是解答此类题目的关键。
(1)先分析灼烧固体物质所用的仪器有哪些,然后从中选出硅酸盐质的实验仪器:瓷坩埚、泥三角、酒精灯(极易漏选酒精灯)。
(2)海带灼烧后的灰烬中含有可溶性I-和难溶固体物质。要得到含有I-的溶液,须将灰烬充分溶解,并进行过滤除去残渣。
(3)浓硫酸、新制氯水、KMnO4溶液、H2O2均能将I-氧化为I2。前三者可在溶液中引入新的杂质,而H2O2的还原产物为H2O,无其他物质生成,所以氧化剂最好选用H2O2。


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
下列各组物质中,按单质、化合物、混合物顺序排列的是( )。
A.铁、四氧化三铁、冰水混合物 B.金属钙、生石灰、碱石灰
C.水银、空气、干冰 D.二氧化硫、水蒸气、天然气
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的SO2和SO3相比较,下列结论错误的是( )。
A.分子数之比为1∶1 B.所含原子数之比为2∶3
C.质量之比为1∶1 D.氧原子数之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+含量比
(b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量
(d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + 2NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42ˉ与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42ˉ与Fe3+物质的量之比。
(4)测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。

主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数计算式为
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是
A.根据纯净物的元素组成,将纯净物分为单质和化合物
B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2 N2(g)+CO2(g) + 2H2O(g) ΔH2、
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2= ;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3 ,则在电化学合成氨的过程中,阴极反应式为 ;
2NH3 ,则在电化学合成氨的过程中,阴极反应式为 ;
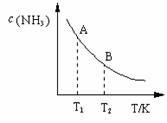 (3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①A点时N2的浓度为 mol/L;
②右图中在状态A时,平衡常数 KA =
(填写代入数值的表达式,不要求化简);当温度由T1变化到T2时,KA KB(填“>”、“<”或“=”)。
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 时间/min 浓度/mol•L—1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
反应从0 min到3 min之间,H2的反应速率为 ;反应在3 min时,条件发生了改变,改变的条件可能是 (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度 d.充入Ne增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
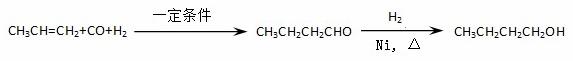
CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如下图)
CO↑+H2O,并设计出原料气的制备装置(如下图)

请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯。写出化学方程式: , 。
(2)若用以上装置制备干燥纯净的CO,装置中 a和b的作用分别是 , ;
a和b的作用分别是 , ;
C和d中承装的试剂分别是 , 。若用以上装置制备H2, 气体发生装置中必需的玻璃仪器名称是 ;在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________________(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水
④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是______________。
a. 低温、高压、催化剂 b. 适当的温度、高压、催化剂
c. 常温、常压、催化剂 d. 适当的温度、常压、催化剂
(5)正丁醛经催化剂加氢得到含少量正丁醛的1—丁醇粗品,为纯化1—丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1—丁醇118℃,并设计出如下提纯路线:
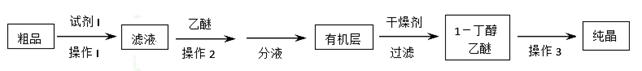
试剂1为_________,操作1为________,操作2为_______,操作3为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com