
����Ŀ���±�ΪԪ�����ڱ���һ���֣�������ŷֱ����ijһԪ�ء���ش��������⡣
(1)�١����У�����õĽ���Ԫ����________(дԪ�ط��ţ���ͬ)������õ�Ԫ����________��
(2)�٢�ļ����ӣ���뾶�������________(д���ӷ���)��
(3)������̬�⻯����ȶ�����____________(�ѧʽ)��
(4)Ԫ�صķǽ����ԣ���________��(����������������)��
(5)�١��������������ˮ�����У�������ǿ����____________(�ѧʽ)��������ǿ����__________(�ѧʽ)���ü���ݵ�����������ˮ���ﷴӦ�����ӷ���ʽΪ__________��
���𰸡�K Ne F�� HF �� HClO4 KOH Al(OH)3��OH��= AlO2-��2H2O
��������
����Ԫ�������ڱ��е�λ�ÿ�֪����ΪNaԪ�أ���ΪKԪ�أ���ΪMgԪ�أ���ΪCaԪ�أ���ΪAlԪ�أ���ΪSiԪ�أ���ΪNԪ�أ���ΪFԪ�أ���ΪClԪ�أ���ΪNeԪ�أ����Ԫ�������ɷ������
(1) ͬһ���ڣ��������ң������Լ�����ͬһ���壬���ϵ��£���������ǿ���١����У�����õĽ���Ԫ����K��ϡ����������ã�����õ�Ԫ����Ne���ʴ�Ϊ��K��Ne��
(2) һ����ԣ����Ӳ���Խ�࣬�뾶Խ���Ӳ�����ͬ��ԭ������Խ�뾶ԽС��
�٢�ļ����ӵ��Ӳ�����ͬ����뾶�������F�����ʴ�Ϊ��F����
(3) �ǽ�����Խǿ����Ӧ�⻯��Խ�ȶ����ǽ�����F��Cl����̬�⻯����ȶ�����HF���ʴ�Ϊ��HF��
(4) ͬһ���ڣ��������ң��ǽ�������ǿ��ͬһ���壬���ϵ��£��ǽ����Լ�����Ԫ�صķǽ����ԣ���(Si)����(N)���ʴ�Ϊ������
(5) ͬһ���ڣ��������ң�Ԫ�صķǽ���������ǿ����ۺ��������������ǿ��ͬһ���壬���ϵ��£�Ԫ�صķǽ�������������ۺ��������������������F�����ۣ��١��������������ˮ�����У�������ǿ����HClO4��ͬһ���ڣ��������ң�Ԫ�صĽ���������������������ˮ����ļ���������ͬһ���壬���ϵ��£�Ԫ�صĽ���������ǿ����Ӧ������������ˮ����ļ�������ǿ��������ǿ����KOH����(Al)������������ˮ����Ϊ�������������߷�Ӧ�����ӷ���ʽΪAl(OH)3��OH��= AlO2-��2H2O���ʴ�Ϊ��HClO4��KOH��Al(OH)3��OH��= AlO2-��2H2O��


 ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ����ǿ������Һ���ܴ���������ǣ� ��
A.K+��Na+��OH-��Cl��
B.Na+��K+��Cl����SO42-
C.Ca2+��Na+��CO32-��NO3-
D.Cu2+��SO42-��Mg2+��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˶����ⶨŨ�������ǿ�����Ե����Ũ�ȣ�ij�о�С����Ƶ�ʵ�鷽��Ϊ��ȡ18.4mol��L-1Ũ����a mL������п��A�з�Ӧ�������ɵ�����ͨ��ij��Һ���ⶨ���ɳ�����������
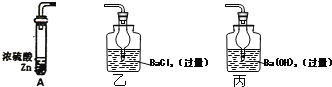
��1��A�в���������Ӧͨ��ͼ��__________����ҡ�������װ�ã�
��2����ͬѧ��ΪҪ��Сʵ������Ҫ����һ������Ӧ���ɵ�SO2ȫ���ų��IJ�������Ҳ��ͬѧ��Ϊû�б�Ҫ����������____________________________________��
��3������������Ϊb g����Ũ�������ǿ������ʱ�����Ũ��Ϊ________________������ ��a��b�Ĵ���ʽ��ʾ�����Է�Ӧ������Ũ��������仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�����ڱ���λ�ÿ�����Ԫ�ؾ������Ƶ�������һ���ɣ�������Ԫ�����ڱ�Ѱ���²��ϡ�����˵������ȷ����
A. �ڽ���Ԫ�غͷǽ���Ԫ�صĽ��紦Ѱ�Ұ뵼�����
B. �ڹ���Ԫ����Ѱ�����²���
C. �ڹ���Ԫ����Ѱ�������Ĵ���
D. �ڽ���Ԫ������Ѱ������ũҩ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ϻ���һ�������Դ����,����������Щ��Դ�ǿ�ѧ�о�����Ҫ���⡣��ͼΪ��ˮ��Դ���õIJ��ֹ���,�й�˵����ȷ���ǣ� ��

A. ��ˮ�����ķ�����Ҫ����������������������
B. �ȼҵ�в��������ӽ���Ĥ����߲�Ʒ�Ĵ���
C. ��MgCl2��6H2O�õ���ˮMgCl2�Ĺؼ���Ҫ����С����
D. �幤ҵ�Тۡ��ܵ�Ŀ����Ϊ�˸�����Ԫ�أ���Ԫ���ڷ�Ӧ�ۡ����о����������ڷ�Ӧ���б���ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ�
A. ���ӵ�ء�Ǧ���غͼ���п�̸ɵ�ض��Ƕ��ε��
B. ��ѧ��صķ�Ӧ������������ԭ��Ӧ
C. ����ȼ�ϵ���ڸ���ͨ���������
D. ��п��أ�2Ag+Zn(OH)2![]() Ag2O+Zn+H2O���ŵ�ʱ�������Ϸ�����Ӧ����Ag
Ag2O+Zn+H2O���ŵ�ʱ�������Ϸ�����Ӧ����Ag
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
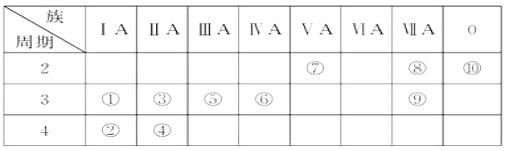
����Ŀ���±���Ԫ�����ڱ���һ����, ��Ա��еĢ١�����Ԫ�أ���д���пհף�
���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� | �� |
��1��Ԫ�آ�����Ϊ____�����ڱ��е�λ��_____��
��2��������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ��____��������ǿ�Ļ�����ĵ���ʽ�ǣ�_____��
��3���õ���ʽ��ʾ�آ���Ļ�������γɹ��̣�_____���û���������____(����ۡ������ӡ�)�����
��4��д��һ��������Ԫ����ɵļ������Ӽ����зǼ��Թ��ۼ������ʵĻ�ѧʽ_____��
��5���ޡ��ߡ�������Ԫ���γɵ����ӣ����Ӱ뾶�ɴ�С��˳����_______�������ӷ��ű�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩ�л����ʵķ���ʽ��ȡ�ʵ����λ���㣮���м����д�����ǣ� ��
A. �������ļ��顢��ϩ����Ȳ���ȼ�գ����ĵ����������ʵ�����������
B. Wg�����dz��ȼ�պ�ȼ�ղ��ᆳ��������Na2O2��ַ�Ӧ��������������Wg
C. �����������״��ϩ���������������������Ϊa����̼������������![]()
D. �����ʵ������Ҵ����ϩ��![]() ���ȼ�գ����ĵ����������ʵ�����ͬ
���ȼ�գ����ĵ����������ʵ�����ͬ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com