
 .
.分析 (1)不成对电子数即为单电子数最多的是N,有三个不成对电子,不成对电子数与该周期序数相等的元素有铍和氧2种元素;
(2)BF3的空间构型为平面三角形,键角为120°,NF3的分子构型为三角锥形,键角为107°,所以键角:BF3>NF3;非羟基氧数目越多,酸性越强;
(3)①硅原子半径远大于氧,硅的价层轨道与氧的价层轨道重叠程度小,难形成稳定的π键;
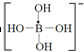
②含硼离子的结构式为 ;
;
(4)金属银采用面心立方最密堆积,以晶胞顶点上的银原子为例,与之距离最近的银原子分布在经过该原子的12个面的面心上,距离为面对角线的一半,所以银原子的配位数为12,晶胞内银原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞的棱长为 acm,故ρa3=$\frac{4×M}{{N}_{A}}$,ρa3=$\frac{4×108}{{N}_{A}}$,NA=$\frac{432}{ρ{a}^{3}}$.
解答 解:(1)不成对电子数即为单电子数最多的是N,有三个不成对电子,不成对电子数与该周期序数相等的元素有铍和氧2种元素,故答案为:氮或N;2;
(2)BF3的空间构型为平面三角形,键角为120°,NF3的分子构型为三角锥形,键角为107°,所以键角:BF3>NF3;非羟基氧数目越多,酸性越强,故H2SeO4有2个非羟基氧,H2SeO3有1个非羟基氧,故酸性H2SeO4 >H2SeO3,故答案为:>;>;
(3)①硅原子半径远大于氧,硅的价层轨道与氧的价层轨道重叠程度小,难形成稳定的π键,硅与氧不能形成类似CO结构的稳定的SiO分子,故答案为:硅原子半径远大于氧,硅的价层轨道与氧的价层轨道重叠程度小,难形成稳定的π键;
②H3BO3水溶液的酸性(H+)是来源于水的电离,故含硼离子的结构式为 ,故答案为:
,故答案为: ;
;
(4)金属银采用面心立方最密堆积,以晶胞顶点上的银原子为例,与之距离最近的银原子分布在经过该原子的12个面的面心上,距离为面对角线的一半,所以银原子的配位数为12,晶胞内银原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞的棱长为 acm,故ρa3=$\frac{4×M}{{N}_{A}}$,ρa3=$\frac{4×108}{{N}_{A}}$,NA=$\frac{432}{ρ{a}^{3}}$,故答案为:12;NA=$\frac{432}{ρ{a}^{3}}$.
点评 本题考查原子结构、晶体结构、对晶胞的理解与计算等,难度较大,对晶胞的计算注意均摊法的利用,需要学生具备空间想象能力,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
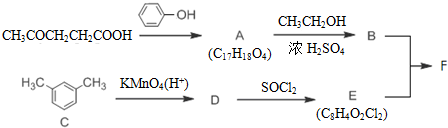
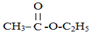 相关物质间转化关系如图:
相关物质间转化关系如图: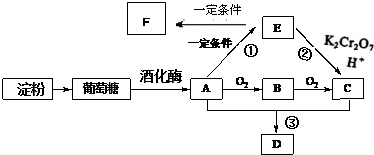
 +CH2CH2OH$?_{△}^{浓硫酸}$
+CH2CH2OH$?_{△}^{浓硫酸}$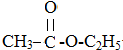 +H2O
+H2O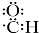

 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
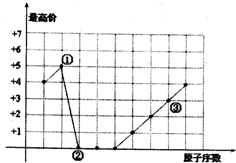
| A. | ①、②形成的化合物的摩尔质量可能是44g/mol | |
| B. | ①、③可以按原子个数比1:l形成化合物 | |
| C. | ②、③形成的化合物是两性物质 | |
| D. | 单核简单离子半径大小为:②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )
元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )| A. | 原子半径及离子半径:X>T | |
| B. | R、T、Q的氢化物的热稳定性和还原性均依次减弱 | |
| C. | 相同物质的量的T、Z的单质的质量中Z的大 | |
| D. | T的非金属性比X的非金属性强,因此T的含氧酸的酸性比X的含氧酸的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
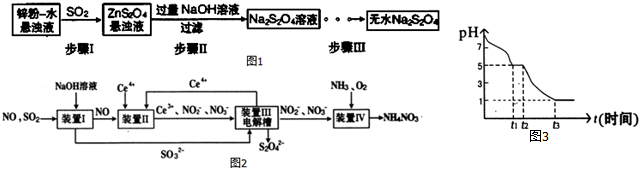
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<Y<Z<W | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | Y、Z、W均可与Mg形成离子化合物 | |
| D. | 最高价氧化物对应水化物的酸性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
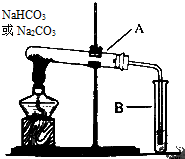 某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.
某校化学兴趣小组,通过如图装置探究Na2CO3和NaHCO3的热稳定性,探究方案设计如下,请你参与并完成该探究方案.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
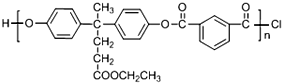
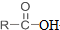 +SOCl2→
+SOCl2→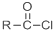 +SO2+HCl
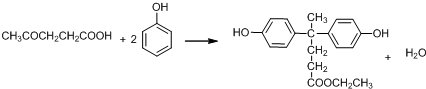
+SO2+HCl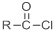 +R′OH→
+R′OH→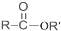 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)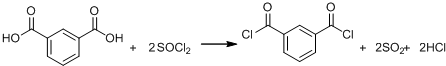 .
. .
.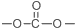 结构.
结构.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com