
| 2.8g |
| 56g/mol |
| 1.12L |
| 22.4/mol |
| 0.21mol |
| 0.1L |
| 3 |
| 8 |


科目:高中化学 来源: 题型:
| A、平衡时X的浓度为0.2mol?L-1 |
| B、a的值为2 |
| C、反应速率v(Y)=0.3mol?(L?min)-1 |
| D、Y的转化率为60% |
查看答案和解析>>
科目:高中化学 来源: 题型:
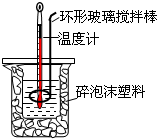 测定中和热实验装置如图:
测定中和热实验装置如图:| 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |
 |
 |
 |
 |
 |
| 序号 | a | b | c | d | e | f |

| 温度 实验次数 |
超始温度t1/℃ | 终止温度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.| 实 验 用 品 | 溶 液 温 度 | 中和热△H(平均值) | ||
| t1 | t2 | |||
| ① | 50mL0.55mol?L-1NaOH 50mL.0.5mol?L-1HCl |
20℃ | 23.3℃ | |
| ② | 50mL0.55mol?L-1NaOH 50mL.0.5mol?L-1HCl |
20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com