
| 物质 浓度 |
CO | H2O | CO2 | H2 |
| 起始浓度/(mol?L-1) | 2.0 | 8.0 | 0 | 0 |
| 平衡浓度/(mol?L-1) | 0.4 | 6.4 | 1.6 | 1.6 |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 1.6mol/L |
| 10min |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 1.6×1.6 |
| 0.4×6.4 |


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
| A、过量的SO2通人NaOH溶液中:SO2+2OH-=SO32-+H2O |
| B、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
| C、碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D、少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 73 |
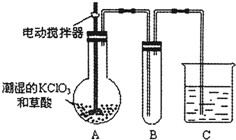
查看答案和解析>>
科目:高中化学 来源: 题型:
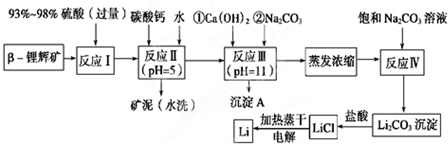
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 品 名 | 肉 松 卷 |
| 配 料 | ①小麦粉 ②肉松 ③植物油 ④食用盐 ⑤苯甲酸钠 ⑥β-胡萝卜素等 |
| 生产日期 | 标于包装袋封口上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| C、pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后所得溶液显酸性 |
| D、将0.1mol/L的氨水溶液加水稀释10倍,溶液中离子浓度都减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量的金属铜投入浓硝酸中 Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
| B、铝片投入稀盐酸中 Al+6H+=Al3++3H2↑ |
| C、氢氧化钡溶液与稀硫酸混合 Ba2++SO42-=BaSO4↓ |
| D、氧化铝固体与烧碱溶液混合Al2O3+2OH-=AlO2-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com