
| A. | 2L1mol/LNaF溶液中含Na+和F-之和为4NA | |
| B. | 在常温常压下,22gCO2含有的共用电子对数为2NA | |
| C. | 7.1g氯气与足量的NaOH溶液反应,转移电子数为0.2NA | |
| D. | 11mol甲基(-CH3)中所含电子数为10NA |
分析 A、F-为弱酸根;
B、求出二氧化碳的物质的量,然后根据1mol二氧化碳中含4mol共用电子对来分析;
C、求出氯气的物质的量,然后根据氯气和碱的反应为歧化反应来分析;
D、甲基不带电荷.
解答 解:A、F-为弱酸根,在溶液中会水解,故溶液中的钠离子和氟离子个数之和小于4NA个,故A错误;
B、22g二氧化碳的物质的量为0.5mol,而1mol二氧化碳中含4mol共用电子对,故0.5mol二氧化碳中含2NA对共用电子对,故B正确;
C、7.1g氯气的物质的量为0.1mol,而氯气和碱的反应为歧化反应,故0.1mol氯气转移0.1mol电子即0.1NA个,故C错误;
D、甲基不带电荷,故1mol甲基含9mol电子即9NA个,故D错误.
故选B.
点评 题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1mol氯气参加氧化还原反应时电子转移数一定是2NA | |
| B. | 常温常压下,56 g Fe与足量的盐酸完全反应转移的电子数为3NA | |
| C. | 同温同压下,等质量的H2和O2的体积之比是16:1 | |
| D. | 0.1mol/L的MgCl2溶液中Cl-离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |  |  |
| ① | ② | ③ | ④ |
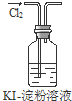
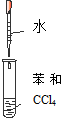
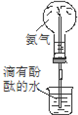
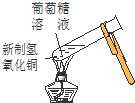
| A. | 实验①中溶液出现蓝色 | |
| B. | 实验②试管出现分层现象,上下为油层,中间为水层 | |
| C. | 实验③中烧瓶内溶液变红色 | |
| D. | 实验④中出现砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量CO2通入Na2SiO3溶液:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| B. | 醋酸与NaOH溶液反应:H++OH-═H2O | |
| C. | 氧化镁溶于稀硫酸:MgO+2H+═H2O+Mg2+ | |
| D. | 向AlCl3溶液中加入过量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、HCO3-、Cl- | B. | K+、Fe2+、Cl-、OH- | ||
| C. | Ag+、Al3+、NO3-、H+ | D. | Fe3+、Al3+、SCN-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
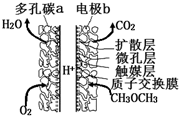 一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )
一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )| A. | 多孔碳a能增大气固接触面积,提高反应速率,该电极为负极 | |
| B. | 电极b上发生的反应为:CH3OCH3-12e-+3H2O═2CO2+12H+ | |
| C. | H+由b电极向a电极迁移 | |
| D. | 二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇(CH3OH)直接燃料电池能量密度的1.4倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl、AgBr、AgI均是难溶于水的固体,且要避光保存于棕色瓶中 | |
| B. | AgCl是白色难溶于水的固体,用于指纹鉴定有助于警察破案 | |
| C. | AgBr是黑色光敏性物质,常用于制作胶卷和人工降雨 | |
| D. | AgI是黄色固体,见光容易分解为单质碘和黑色的单质银,还常用于人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com