
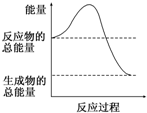
| A. | △H>0 | B. | △H<0 | C. | △H=0 | D. | 无法判断 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
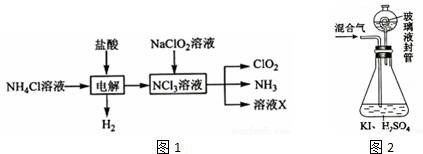
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
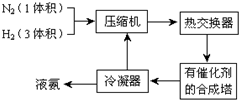
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可利用该反应进行人工固氮 | |
| B. | 将3mol N2(g)和3mol H2(g)混合,在高温、高压和催化条件下充分反应,放出热量92.22kJ | |
| C. | 因为反应需要加热,所以反应放出热量 | |
| D. | 其他条件相同时,采用更高效的正催化剂,既能提高反应速率,又能增大反应放热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
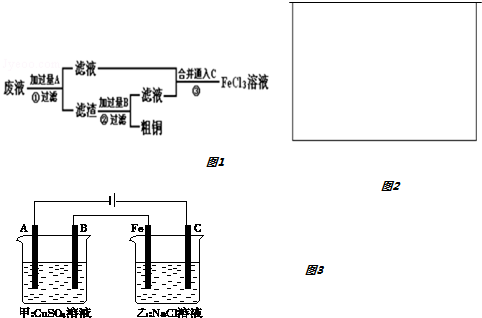
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
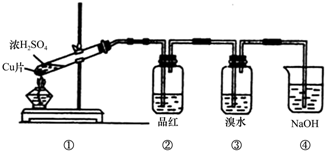
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
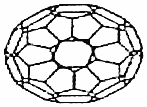
| A. | C60的摩尔质量是720 g•moL-1 | |
| B. | 1 mol C60完全燃烧生成22.4 L CO2 | |
| C. | C60属于有机化合物 | |
| D. | C60的结构与金刚石一样 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com