
(1)写出用CnH2n+2表示的人工合成汽油的配平的化学方程式_______________________。
(2)如果向密闭的合成塔里通入恰好能完全反应的CO和H2,当完全反应后,合成塔内温度不变,而塔内气体压强降低到原来的2/5。通过计算说明这时有无汽油生成。
(3)要达到上述合成汽油的要求,CO和H2的体积比的取值范围是多少?
科目:高中化学 来源: 题型:
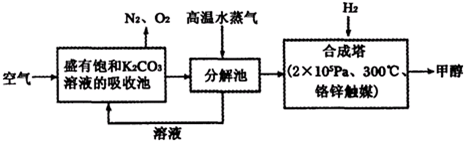
 利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径.
利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径.
| ||
| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.2 | 0.4 |
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高二版(选修4) 2009-2010学年 第3期 总第159期 人教课标版(选修4) 题型:022
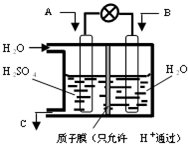
氢能是高效、清洁的能源,制氢技术的研究开发是氢能利用的必由之路.燃料水蒸气重整法是一种有效、经济、广泛采用的制氢方法,它是通过水蒸气与燃料间的反应来制取氢气的.
(1)在催化剂作用下,天然气和水蒸气反应可制得一氧化碳和氢气,已知该反应每制得1 kg氢气需要吸收3.44×104 kJ热量.写出该反应的热化学方程式:________.
(2)CO还可继续与水蒸气反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.0 kJ/mol.若将1 mol CH4与足量水蒸气充分反应得到1 mol CO2,该反应的焓变ΔH=________.
CO2(g)+H2(g) ΔH=-41.0 kJ/mol.若将1 mol CH4与足量水蒸气充分反应得到1 mol CO2,该反应的焓变ΔH=________.
(3)欲制得较纯净的氢气,可将(2)中充分反应后的气体通过足量的烧碱溶液,写出该反应的离子方程式:________.
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
 CH3OH (g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH (g),CO的平衡转化率与温度、压强的关系如图所示,则: 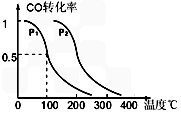
 CO(g) + 2H2(g)反应的平衡常数为________(用含a、V的代数式表示)
CO(g) + 2H2(g)反应的平衡常数为________(用含a、V的代数式表示)  SO3(g)+NO(g)上述反应,正反应速率随时间变化的趋势如图所示。由图可知下列说法正确的是__________(填字母)。
SO3(g)+NO(g)上述反应,正反应速率随时间变化的趋势如图所示。由图可知下列说法正确的是__________(填字母)。 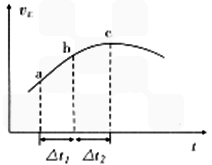
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省泰州市泰兴市高三(上)期中化学试卷(解析版) 题型:填空题
 CO(g)+3H2(g),△H= kJ?mol-1.标准状况下33.6L甲烷高温下与水蒸气完全反应生成CO和H2,反应过程中转移 mole-,放出 kJ热量.
CO(g)+3H2(g),△H= kJ?mol-1.标准状况下33.6L甲烷高温下与水蒸气完全反应生成CO和H2,反应过程中转移 mole-,放出 kJ热量.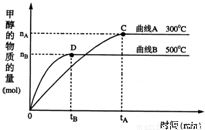
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com