
| 选项 | 样品(杂质) | 加入试剂主 | 要仪器 | 主要操作方法 |
| A | Fe2O3(Al2O3) | NaOH溶液 | 长颈漏斗 | 过滤、洗涤 |
| B | NaCl(NH4Cl) | Ca(OH)2 | 试管 | 加热 |
| C | 乙醇(水) | CaO | 蒸馏烧瓶 | 蒸馏 |
| D | NaCl溶液(Br2) | 乙醇 | 分液漏斗 | 萃取、蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
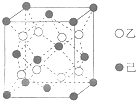 乙、丙、丁简单离子的核外电子排布相同,这三种元素按6:3:1的原子个数比可形成一种离子晶体W;丙与戊可形成常见离子晶体X,甲与己可形成常见离子晶体Y,且X和Y电子数相同.
乙、丙、丁简单离子的核外电子排布相同,这三种元素按6:3:1的原子个数比可形成一种离子晶体W;丙与戊可形成常见离子晶体X,甲与己可形成常见离子晶体Y,且X和Y电子数相同.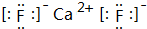 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 丙三醇和足量金属钠反应可以产生 3 mol H2 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色说明甲基对苯环性质有影响 | |
| C. | 丙烯的二氯代物有 5 种 | |
| D. | 芳香烃的通式是 CnH2n-6 (n≥6,n∈N) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
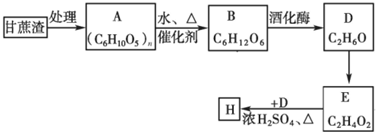
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
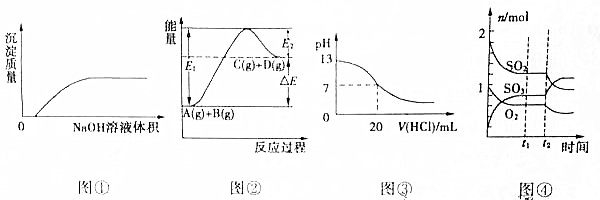
| A. | 图①表示将NaOH溶液滴入Ba(HCO3)2溶液中 | |
| B. | 图②表示反应物的总键能小于生成物的总键能 | |
| C. | 图③表示25℃时,0.1mol/L盐酸滴入20mL0.1mol/LNaOH溶液中,溶液的pH随加入酸体积的变化曲线 | |
| D. | 图④表示一定条件下的反应2SO2(g)+O2?2SO3(g)△H<0,t2时刻改变的条件可能是降低温度或缩小容器体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 滤液I的主要成分是Na2SiO3、NaAlO2和NaOH | |
| B. | 滤液III的含大量的阴离子是HCO3- | |
| C. | 反应Y的离子方程式是2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 滤液II中通入过量的X的目的是使AlO2-充分沉淀而不引进杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g由NO2和N2O4组成的混合物中氧原子总数为0.2NA | |
| B. | 标准状况下,22.4L的SO3中含3NA个氧原子 | |
| C. | 100mL18.4mol/L的浓硫酸与足量的铜加热反应,转移的电子数为1.84NA | |
| D. | 密闭的容器中,催化剂作用下0.5molN2与1.5molH2反应后得到NH3分子数一定为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA | |
| B. | 标况下33.6mL氯气通入足量水中发生反应,转移电子数为1.5×10-3NA | |
| C. | 常温常压下,28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个 | |
| D. | 同温下,pH=1体积为1L的硫酸溶液所含氢离子数与pH=13体积为1L的氢氧化钠溶液所含氢氧根离子数均为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com