
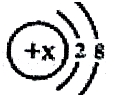 当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为Al(NO3)3.
当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为Al(NO3)3. 分析 根据当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子,以此解答该题.
解答 解:某简单粒子的结构示意图可表示为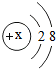 .当X=8时,质子数=8,核外电子数=10,质子数<核外电子数,为氧离子,粒子的符号为O2-;
.当X=8时,质子数=8,核外电子数=10,质子数<核外电子数,为氧离子,粒子的符号为O2-;
当X=11时,质子数=11>核外电子数=10,为钠离子,其离子符号为:Na+;
当X=13时,质子数=13,核外电子数=10,质子数>核外电子数,为铝离子;与硝酸根化合形成的化合物为硝酸铝,铝元素显+3价,硝酸根显-1价,其化学式为:Al(NO3)3,
故答案为:O2-;Na+;Al(NO3)3.
点评 本题考查原子结构和元素的性质,为高频考点,侧重考查学生的分析能力和双基知识的掌握,注意把握原子核外电子的排布特点,难度不大.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:推断题
 )的一条路线如图:
)的一条路线如图: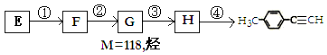
 .
. 、
、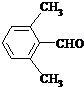 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定存在SO42-和Cl- | |
| B. | 取③中滤液加入KSCN,溶液显红色,则原溶液一定有Fe3+ | |
| C. | 原溶液中一定不存在Ba2+和HCO3- | |
| D. | 为确定原溶液中是否含有K+,可通过焰色反应直接观察焰色是否为紫色来确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
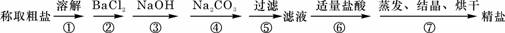
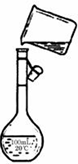 (5)为检验精盐纯度,需配制100mL 1mol/L NaCl溶液,右图是该同学转移溶液的示意图,图中的错误是未用玻璃棒引流
(5)为检验精盐纯度,需配制100mL 1mol/L NaCl溶液,右图是该同学转移溶液的示意图,图中的错误是未用玻璃棒引流查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O═H2CO3 | B. | CO+CuO═Cu+CO2 | ||
| C. | 2H2O═2H2↑+O2↑ | D. | FeS+H2SO4═FeSO4+H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为电池的正极 | |
| B. | 负极反应式为2FeO42-+10H++6e-═Fe2O3+5H2O | |
| C. | 该电池使用完不可随便丢弃,应深埋地下 | |
| D. | 电池工作时OH-向负极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不粘锅的原料 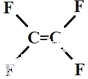 为烃类化合物 为烃类化合物 | |
| B. | 分子组成相差1个或若干个“CH2”原子团的有机物,互称为同系物 | |
| C. | 石油分馏是物理变化,煤的气化、液化是化学变化 | |
| D. | 聚乙烯塑料袋因有毒,不可以装食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH-+3SO2═SO32-+2HSO3-+H2O | |
| B. | 碳酸氢镁中加过量氢氧化钠:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| D. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com