
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
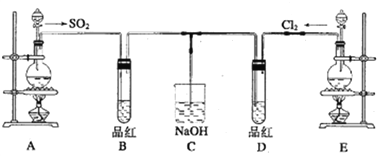
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,该同学怎样操作可以使分液漏斗液体顺利滴下___________________________;
(2)实验室用装置E制备Cl2,其反应的化学方程式为____________________,若实验室用酸性KMnO4和浓盐酸反应制Cl2,反应的离子方程式为________________________。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:_______________________,D:_________________________。
(4)若将B中品红换成Na2S溶液,通SO2一段时间后B中现象为_____________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________。
【答案】 取下分液漏斗的玻璃塞 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 褪色的品红溶液又恢复成红色 无明显现象 溶液变浑浊(或有沉淀生成) Cl2+SO2+2H2O=2HCl+H2SO4
MnCl2+Cl2↑+2H2O 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 褪色的品红溶液又恢复成红色 无明显现象 溶液变浑浊(或有沉淀生成) Cl2+SO2+2H2O=2HCl+H2SO4
【解析】试题分析:(1)打开A的分液漏斗活塞后,漏斗中液体未流下,说明分液漏斗内压强小于外界大气压;(2)装置E适合二氧化锰与浓盐酸加热制备Cl2;酸性KMnO4和浓盐酸反应生成Cl2、氯化锰、氯化钾、水;(3)SO2、Cl2都能使品红褪色,SO2漂白具有暂时性,加热后可以恢复原色,次氯酸是氧化性漂白,具有永久性。(4)若将B中品红换成Na2S溶液,通SO2后可以发生5 SO2 + 2 Na2S + 2 H2O == 3 S↓+ 4 NaHSO3;(5)SO2和Cl2 、H2O发生氧化还原反应生成HCl和H2SO4。
解析:(1)打开A的分液漏斗活塞后,漏斗中液体未流下,说明分液漏斗内压强小于外界大气压,可以取下分液漏斗的玻璃塞使分液漏斗液体顺利滴下;(2)装置E适合二氧化锰与浓盐酸加热制备Cl2,反应方程式是MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;酸性KMnO4和浓盐酸反应生成Cl2、氯化锰、氯化钾、水,反应离子方程式是2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;(3)SO2、Cl2都能使品红褪色,SO2漂白具有暂时性,加热后可以恢复原色,次氯酸是氧化性漂白,具有永久性,所以给B、D两个试管分别加热,B试管褪色的品红溶液又恢复成红色、D试管无明显现象。(4)若将B中品红换成Na2S溶液,通SO2后发生5 SO2 + 2 Na2S + 2 H2O == 3 S↓+ 4 NaHSO3,现象是溶液变浑浊;(5)SO2和Cl2 、H2O发生氧化还原反应生成HCl和H2SO4,所以品红溶液不褪色,反应方程式是Cl2+SO2+2H2O=2HCl+H2SO4。
MnCl2+Cl2↑+2H2O;酸性KMnO4和浓盐酸反应生成Cl2、氯化锰、氯化钾、水,反应离子方程式是2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;(3)SO2、Cl2都能使品红褪色,SO2漂白具有暂时性,加热后可以恢复原色,次氯酸是氧化性漂白,具有永久性,所以给B、D两个试管分别加热,B试管褪色的品红溶液又恢复成红色、D试管无明显现象。(4)若将B中品红换成Na2S溶液,通SO2后发生5 SO2 + 2 Na2S + 2 H2O == 3 S↓+ 4 NaHSO3,现象是溶液变浑浊;(5)SO2和Cl2 、H2O发生氧化还原反应生成HCl和H2SO4,所以品红溶液不褪色,反应方程式是Cl2+SO2+2H2O=2HCl+H2SO4。


科目:高中化学 来源: 题型:
【题目】元素A和B的原子序数都小于18。已知A元素原子最外层电子数为a,次外层电子数为b;B元素原子的M层电子数是a-b,L层电子数是a+b,则A、B两元素所形成的化合物的晶体类型为
A.分子晶体B.原子晶体C.离子晶体D.金属晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,N2与H2反应过程中能量变化的曲线如图.下列叙述正确的是( ) 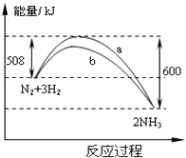
A.该反应的热化学方程式为:N2+3H22NH3△H=﹣92kJ/moL
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的放热增多
D.加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在研究合成氨方法的历史上,不同的研究者曾3次获诺贝尔化学奖。合成氨大大提高了农作物的产量,同时也是制取硝酸、炸药等的原料。下列说法中正确的是
A. N2和H2在点燃或光照条件下可合成NH3
B. NH3和HNO3溶于水后都能导电,故二者都是电解质
C. NH3遇到浓硝酸会发生反应产生大量白烟
D. 由NH3制HNO3的过程中,氮元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLHCl完全溶于水得到VmL盐酸,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为CmolL。下列叙述中错误的是
A. 可利用CCl4和水吸收HCl,且能防倒吸
B. ω=![]() ×100%
×100%
C. c= ![]() mol/L
mol/L
D. 上述溶液中再加入VmL水,所得溶液的质量分数小于0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 将钠投入到CuCl2溶液中:2Na+Cu2+===Cu+2Na+
B. Na与水反应:Na+2H2O===Na++2OH-+H2↑
C. 铝和NaOH溶液的反应:2Al+2OH-+2H2O===2AlO![]() +3H2↑
+3H2↑
D. 铁屑与硫酸的反应:2Fe+6H+===2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度不同压强(P1<P2)下,可逆反应2X(g)2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
A.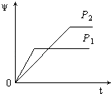
B.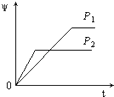
C.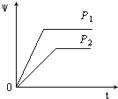
D.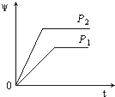
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用500mL 2.0mol/L NaOH溶液吸收0.8mol SO2后,SO32- 和HSO3- 的物质的量浓度之比是( )
A. 1 : 3 B. 3:1 C. 5:4 D. 4: 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下进行甲、乙、丙三组实验,三组实验均各取30mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据如表:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
生成气体体积/mL | 280 | 336 | 336 |
(1)乙组实验中,盐酸______(填“过量”、“适量”、“不足量”)。
(2)盐酸的物质的量浓度为_______。
(3)要计算合金中镁、铝的物质的量之比,题中可作为计算依据的数据是_______(填“甲组”、“乙组”或“丙组”),求得的镁、铝的物质的量之比是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com