
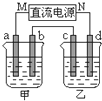
 如图所示的装置中,甲、乙两烧杯中分别盛放有足量的CuSO4溶液和100g 10.00%的K2SO4溶液,a、b、c、d均为石墨电极.接通电源一段时间后,测得乙中K2SO4溶液浓度为10.47%,甲中a电极的质量增加.下列说法正确的是( )
如图所示的装置中,甲、乙两烧杯中分别盛放有足量的CuSO4溶液和100g 10.00%的K2SO4溶液,a、b、c、d均为石墨电极.接通电源一段时间后,测得乙中K2SO4溶液浓度为10.47%,甲中a电极的质量增加.下列说法正确的是( )| A、甲、乙溶液的pH均减小 | B、电极b上生成气体的体积约为2.8L(标准状况下) | C、电极d上发生的反应为:2H2O+2e-?H2↑+2OH- | D、欲使甲中的溶液恢复至原来的浓度,可加入24.5g的Cu(OH)2 |
| 4.49g |
| 18g/mol |
| 24.5g |
| 98g/mol |


科目:高中化学 来源: 题型:
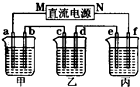 目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)
目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)| 电极 | a | b | c | d | e | f |
| 石墨 | 石墨 | 铜 | 钢 | 钢 | 铜 | |
| 溶液 | NaCl溶液 | CuSO4溶液 | CuSO4溶液 | |||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省杭州市西湖高级中学高一5月月考文科化学试卷(带解析) 题型:填空题
如图所示的装置中,甲为铜锌原电池,A、B均为石墨电极,请回答下列问题: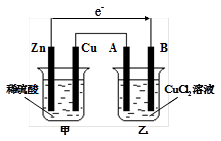
(1)Zn电极为 极,B电极上的产物是 (写化学式)
(2)写出乙装置中发生反应的化学方程式
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州市高一5月月考文科化学试卷(解析版) 题型:填空题
如图所示的装置中,甲为铜锌原电池,A、B均为石墨电极,请回答下列问题:

(1)Zn电极为 极,B电极上的产物是 (写化学式)
(2)写出乙装置中发生反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)
目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)| 电极 | a | b | c | d | e | f |
| 石墨 | 石墨 | 铜 | 钢 | 钢 | 铜 | |
| 溶液 | NaCl溶液 | CuSO4溶液 | CuSO4溶液 | |||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com