
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 ①5.6g铁粉物质的量n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,能100mL、3mol/L HNO3溶液中硝酸溶质物质的量n(HNO3)=0.100L×3mol/L=0.3mol,结合铁过量和硝酸反应的定量关系就是分析判断;
②两种酸溶液混合反应后,溶液的酸性减弱,氢离子浓度减小;
③能制备农药的元素为非金属元素;
④加入氯水分别和物质发生反应生成溴单质、碘单质、气体、白色沉淀等,和氢氧化钠溶液反应无现象;
⑤无法计算该元素的相对原子质量;
⑥合金的硬度一般比各成分金属大,熔点比各成分低;
解答 解:①5.6g铁粉物质的量n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,能100mL、3mol/L HNO3溶液中硝酸溶质物质的量n(HNO3)=0.100L×3mol/L=0.3mol,Fe:HNO3=1:3 若Fe过量,则生成Fe2+,此时方程式 3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O $\frac{3}{8}$>$\frac{1}{3}$可以完全溶解,故①正确;
②氢硫酸和亚硫酸反应生成硫单质和水的反应酸性减弱,两种酸混合溶液酸性可能增强,次氯酸和亚硫酸反应生成硫酸,故②正确;
③能制备农药的元素,如P、As、Cl等为非金属元素,故③错误;
④加入氯水分别和物质发生反应,NaBr反应生成溴单质,溶液中出现橙红色,NaI反应生成碘单质,人员称紫红色,NaOH和氯气反应生成氯化钠、次氯酸钠,反应物现象,Na2CO3和氯水中的盐酸反应生成二氧化碳气体,AgNO3和盐酸反应生成氯化银白色沉淀,用一种试剂可以鉴别下列五种无色溶液,故④正确:
⑤题目已知某元素的一种核素的质子数和中子数,该核素的丰度未知导致无法计算该元素的相对原子质量,故⑤错误;
⑥拟晶具有合金的某些优良物理性能,合金的硬度一般比各成分金属大,熔点比各成分小,故⑥错误;
故选C.
点评 本题考查物质性质、氧化还原反应、合金性质等知识点,比较基础,是高考考查的热点之一,但涉及知识点较多,灵活运用所学知识进行解答,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 该电池可在常温或高温时工作,对环境有较强的适应性 | |
| B. | 负极反应为H2+2OH--2e-=2H2O | |
| C. | 该电池工作时负极有CO2生成 | |
| D. | 该电池供应2molH2O,同时转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W | |
| T |
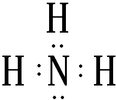 (写电子式);
(写电子式);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
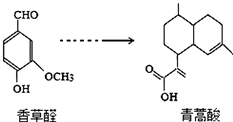
| A. | 在一定条件,香草醛可与HCHO发生缩聚反应 | |
| B. | 两种物质各1mol分别和氢气反应,最多消耗氢气4mol和3mol | |
| C. | 用FeCl3溶液可鉴别化合物香草醛和青蒿酸 | |
| D. | 青蒿酸分子中含有2个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸不能干燥碱性气体NH3,也不可干燥CO、H2等还原性气体 | |
| B. | 常温下,铜片和浓硫酸反应产生的气体可使晶红溶液褪色 | |
| C. | 浓硫酸与磁性氧化铁的反应只表现出浓硫酸的酸性 | |
| D. | 蔗糖与浓硫酸的实验过程及现象表现出浓硫酸具有吸水性、脱水性和强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
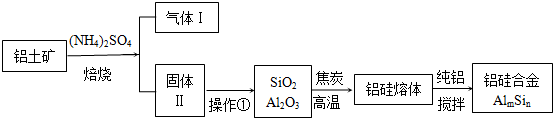
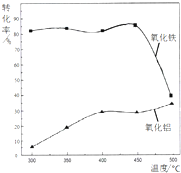
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
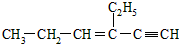 分子中,一定在同一平面内的碳原子数为a,一定在同一直线上的碳原子数为b,处于四面体结构中心的碳原子数为c.则a,b,c依次为( )
分子中,一定在同一平面内的碳原子数为a,一定在同一直线上的碳原子数为b,处于四面体结构中心的碳原子数为c.则a,b,c依次为( )| A. | 4,5,3 | B. | 4,6,3 | C. | 6,3,4 | D. | 4,4,6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
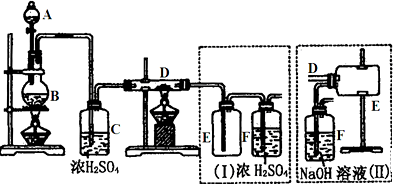
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com