
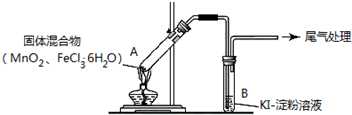
| 操作 | 现象 |
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
| 方案1 | 在A、B 间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
| 方案2 | 将B 中KI淀粉溶液替换为NaBr 溶液;检验 Fe 2+ | B中溶液呈浅橙红色;未检出Fe 2+ |
分析 (1)FeCl3•6H2O 受热失去结晶水,同时水解,生成HCl气体,HCl和H2O结合形成盐酸小液滴;
(2)FeCl3溶液中滴入KSCN溶液,发生络合反应,用KSCN 溶液检验现象ii 和A 中的黄色气体,溶液均变红,说明含有FeCl3;
(3)①氯化铁具有强氧化性,可以将碘离子氧化为碘单质;
②作对照实验,需要除去Cl2 和Fe3+的干扰才能检验酸性情况下的O2 影响,所以最好另取溶液对酸性情况下氧气的影响进行检验.因为原题中存在HCl气体,所以酸化最好选用盐酸;
(4)①方案1:除去Cl2中的FeCl3 和O2(H+),若仍能观察到B中溶液仍变为蓝色,则证明原气体中确实存在Cl2,Cl2 中的氯化氢的去除使用饱和NaCl溶液,饱和NaCl溶液也可以让FeCl3 溶解,并且除去O2 影响过程中提供酸性的HCl气体,从而排除两个其他影响因素;
②方案2:若B中观察到浅橙红色,则证明有物质能够将Br-氧化成Br2,若未检查到Fe2+,则证明是Cl2 氧化的Br-,而不是Fe3+.另外,因为还原剂用的不是I-,可不用考虑O2(H+)的影响问题;
(5)二氧化锰与FeCl3•6H2O 反应生成Fe2O3、MnCl2、Cl2及水,据此结合原子守恒书写化学方程式.
解答 解:(1)FeCl3•6H2O 受热失去结晶水FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeCl3+6H2O,同时水解FeCl3+3H2O?Fe(OH)3+3HCl,生成HCl气体,HCl和H2O结合形成盐酸小液滴,而形成白雾,
故答案为:HCl小液滴;FeCl3•6H2O 受热水解,生成HCl 气体,同时受热失去结晶水,HCl和H2O 结合形成盐酸小液滴;
(2)FeCl3溶液中滴入KSCN溶液,发生络合反应,Fe3++3SCN-=Fe(SCN)3,生成血红色的硫氰化铁,用KSCN 溶液检验现象ii 和A 中的黄色气体,溶液均变红,说明含有FeCl3,
故答案为:FeCl3;
(3)①碘离子具有还原性,氯化铁具有强氧化性,两者反应,碘离子被氧化为碘单质,反应离子方程式为:2Fe3++2I-=2Fe2++I2,
故答案为:2Fe3++2I-=2Fe2++I2;
②FeCl3•6H2O 受热水解,生成HCl气体,作对照实验,需用盐酸酸化,另取一支试管,向其中加入KI-淀粉溶液,再滴入几滴HCl溶液,在空气中放置,观察一段时间后溶液是否变蓝,若一段时间后溶液变蓝则推测成立,
故答案为:另取一支试管,向其中加入KI淀粉溶液,再滴入几滴 HCl溶液,在空气中放置,若一段时间后溶液变蓝则推测成立;
(4)①方案1:氯化铁能氧化碘离子,氧气在酸性条件下,能氧化碘离子,所以需除去Cl2中的FeCl3 和O2(H+),若仍能观察到B中溶液仍变为蓝色,则证明原气体中确实存在Cl2,使用饱和NaCl溶液,可以让FeCl3 溶解,并且除去O2 影响过程中提供酸性的HCl气体,从而排除两个其他影响因素,
故答案为:饱和NaCl溶液;
②方案2:若B中观察到浅橙红色,为溴水的颜色,则证明有物质能够将Br-氧化成Br2,铁离子不能氧化溴离子,若未检查到Fe2+,则证明是Cl2氧化的Br-,而不是Fe3+.另外,因为还原剂用的不是I-,可不用考虑O2(H+)的影响问题,
故答案为:排除Fe3+将Br-氧化成Br2 的可能性;
(5)二氧化锰与FeCl3•6H2O 反应生成Fe2O3、MnCl2、Cl2及水,反应方程式为:3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O,
故答案为:3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.
点评 本题考查物质性质探究实验,侧重对原理分析、陌生方程式的书写等考查,是对学生综合能力的考查,熟练掌握元素化合物性质,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸性:H 2CO 3<C 6H 5OH<H 3COOH | B. | 碱性:Ba(OH) 2<Ca(OH) 2<KOH | ||
| C. | 熔点:MgBr 2<SiCl 4<BN | D. | 沸点:PH 3<NH 3<H 2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
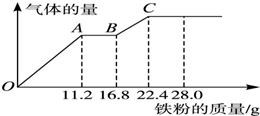 某稀硫酸和稀硝酸的混合溶液200mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.
某稀硫酸和稀硝酸的混合溶液200mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、Mg2+、NO3-、Cl-可以大量共存 | |
| B. | 该溶液能使红色石蕊试纸变蓝,也能使淀粉碘化钾试纸变蓝 | |
| C. | 该溶液和足量Ba(OH)2溶液反应的离子方程式为:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 该溶液与过量锌粉反应的离子方程式为:Zn+2Fe3+═2Fe2++Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每一纵行不是主族就是副族 | |
| B. | 短周期原子的次外层电子数都是8个 | |
| C. | 短周期元素是指原子序数为1~20的元素 | |
| D. | 主族元素所在的族序数等于其原子的最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | v(A)=0.09mol•L-1•s-1 | B. | v(B)=0.06mol•L-1•s-1 | ||
| C. | v(C)=0.9mol•L-1•min-1 | D. | v(D)=3.6mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com