
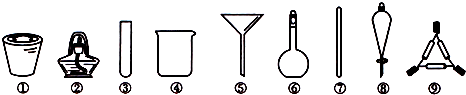
| A. | 将海带高温灼烧,选用①、②、⑨ | |
| B. | 过滤粗盐水,选用④、⑤、⑦ | |
| C. | 四氯化碳萃取溴水中的溴,选用④、⑥、⑧ | |
| D. | 加热碳酸氢钠固体并检验其产物,选用②、③ |
分析 A.将海带灼烧灰化,应在坩埚中加热;
B.过滤使用烧杯、漏斗、玻璃棒;
C.萃取使用烧杯和分液漏斗;
D.加热碳酸氢钠固体用试管和酒精灯.
解答 解:A.将海带灼烧灰化,应在坩埚中加热,用到的仪器有①、②和⑨,必要时还可用到三脚架或铁架台带铁圈,故A正确;
B.过滤时用到④、⑤和⑦,故B正确;
C.萃取使用烧杯和分液漏斗,不需要使用容量瓶,故C错误;
D.加热碳酸氢钠固体并检验其产物,用澄清的石灰水检验,选用②、③、④,故D正确.
故选C.
点评 本题考查物质的检验和鉴别的实验设计,着重于考查学生的分析能力和实验能力,落脚于基础知识的考查,注意把握实验的原理、步骤和实验仪器,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
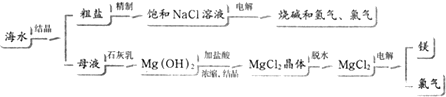
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Mg(OH)2溶于硝酸:OH-+H+=H2O | |
| C. | Al与NaOH溶液反应:Al+2OH-=AlO2-+H2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 密度/g•mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3 2P+5Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com