
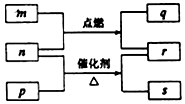
 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )| A. | 原子半径:Y<X<Z | |
| B. | 简单氢化物沸点:X<Y<Z | |
| C. | m与q、n与s均不能共存 | |
| D. | W、X、Y、Z四种元素可组合成离子化合物 |
分析 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,r为H2O,则其余均为无色气体,q能使品红溶液褪色,q为SO2,n是元素Y的单质,结合转化可知,m为H2S,n为O2,m的摩尔质量为p的2倍,则p为NH3,s为NO,结合原子序数可知,W为H,X为N,Y为O,Z为S,以此来解答.
解答 解:由上述分析可知,W为H,X为N,Y为O,Z为S,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:Y<X<Z,故A正确;
B.氨气、水分子间均含氢键,且水分子间氢键数目多,则简单氢化物沸点:Y>X>Z,故B错误;
C.m与q发生氧化还原反应生成S和水、n与s反应生成二氧化氮,均不能共存,故C正确;
D.W、X、Y、Z四种元素可组合成离子化合物为硫酸铵或亚硫酸铵等,故D正确;
故选B.
点评 本题考查无机物的推断,为高频考点,把握r为水、q为二氧化硫来推断物质为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识与规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 短期保存Br2:盛于磨口的细口瓶中,并用水封,瓶盖严密 | |
| B. | 锂、钠、钾都保存在煤油中,密封 | |
| C. | 氨水、浓盐酸易挥发必须保存在棕色磨口细口瓶中 | |
| D. | 红磷无需密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(M) | n(N) | ||
| ① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
| ② | 800 | 0.20 | 0.80 | a | a |
| ③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
| A. | 实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=12.5 | |
| C. | 实验②中,达到平衡时,a大于0.16 | |
| D. | 正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
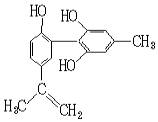 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 有机物分子式为C16H14O3 | |
| B. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| C. | 1 mol该物质分别与浓溴水、H2反应时最多消耗Br2和H2分别为4 mol、7 mol | |
| D. | 滴入KMnO4(H+)溶液,观察紫色褪去,可证明结构中存在碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LC2H2、C2H6的混合气体与22.4LC2H4中所含原子总数均为6NA | |
| B. | 常温下,1L PH=14的NaOH溶液中由水电离出的OH-个数为NA | |
| C. | 标准状况下,11.2L的12C16O和14N2的混合气体中所含中子数和原子数的差值为6NA | |
| D. | 将200mL0.1mol•L-1FeCl3溶液制成胶体,所得Fe(OH)3胶体粒子数为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
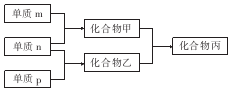 短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )
短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )| A. | X是同周期中非金属性最强的元素 | |
| B. | 元素X、Y、Z的原子半径大小关系为X<Y<Z | |
| C. | Z的氧化物的水化物的酸性在主族元素中最强 | |
| D. | 化合物丙是离子化合物,既含离子键又含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+2 | B. | a+8 | C. | a+26 | D. | a+18 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com