
| 压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
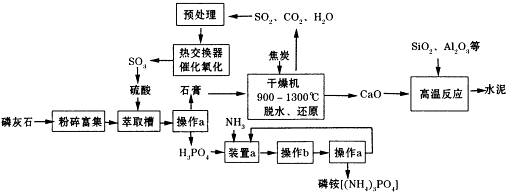
分析 磷灰石粉碎富集后,在萃取槽中用硫酸酸化得到硫酸钙与磷酸,过滤分离得到石膏与磷酸.装置a中磷酸与氨气发生反应,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4,操作b是由溶液中析出晶体,应萃取蒸发浓缩、冷却结晶等操作,铵盐受热容易分解,在结晶时应采用低温蒸发结晶.在经过过滤分离得到磷酸铵,分离得到滤液进行循环利用.石膏在干燥机中脱水、再还原反应得到二氧化碳、二氧化硫、CaO等气体,气体处理后在热交换器中发生催化氧化得到三氧化硫,三氧化硫转化为硫酸,再循环利用.CaO与二氧化硫、氧化铝等反应得到水泥.
(1)操作a是把固体与液体分开,应为过滤;过滤需要烧杯、漏斗、玻璃棒、铁架台(含铁圈)、滤纸等;(2)操作b是由溶液中析出晶体,应萃取蒸发浓缩、冷却结晶等操作,铵盐受热容易分解,在结晶时应采用低温蒸发结晶;
(3)碳与石膏在干燥机内发生反应生成CaO、二氧化硫、二氧化碳与水;
(4)水泥常用做建筑材料,是利用了水泥的水硬性;
(5)①常压下SO2的转化率已经很高,且增大压强时SO2的转化率提高不多,但成本增加较多;
压强一定时,温度越高二氧化硫的转化率越低,说明升高温度平衡向逆反应方向移动;
②移去反应中放出的热量,使反应后的气体降温并预热未反应的气体;
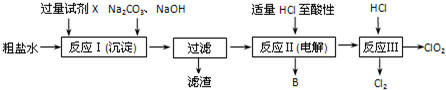
(6)SO2、微量的SO3和酸雾都能与氢氧化钠、碳酸钠反应,不能测定二氧化硫的含量,利用SO2的还原性采用滴定法测定其含量,可以用氧化剂酸性KMnO4溶液、碘水等氧化.
解答 解:磷灰石粉碎富集后,在萃取槽中用硫酸酸化得到硫酸钙与磷酸,过滤分离得到石膏与磷酸.装置a中磷酸与氨气发生反应,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4,操作b是由溶液中析出晶体,应萃取蒸发浓缩、冷却结晶等操作,铵盐受热容易分解,在结晶时应采用低温蒸发结晶.在经过过滤分离得到磷酸铵,分离得到滤液进行循环利用.石膏在干燥机中脱水、再还原反应得到二氧化碳、二氧化硫、CaO等气体,气体处理后在热交换器中发生催化氧化得到三氧化硫,三氧化硫转化为硫酸,再循环利用.CaO与二氧化硫、氧化铝等反应得到水泥.
(1)操作a是分离固体和液体,采取过滤操作;过滤需要盛放药品的烧杯、过滤的漏斗、引流作用的玻璃棒、固定漏斗的铁架台(含铁圈)、滤纸等;
故答案为:过滤;漏斗、玻璃棒、烧杯;
(2)操作b是由溶液中析出晶体,应萃取蒸发浓缩、冷却结晶等操作,铵盐受热容易分解,在结晶时应采用低温蒸发结晶,
故答案为:蒸发浓缩;
(3)碳与石膏在干燥机内发生反应生成CaO、二氧化硫、二氧化碳与水,反应方程式为:2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$ 2CaO+2SO2↑+CO2↑+4 H2O,
故答案为:2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$ 2CaO+2SO2↑+CO2↑+4H2O;
(4)水泥常用做建筑材料,是利用了水泥的水硬性,
故答案为:水硬性;
(5)①常压下SO2的转化率已经很高,且增大压强时SO2的转化率提高不多,但成本增加较多,故选择常压;
压强一定时,温度越高二氧化硫的转化率越低,说明升高温度平衡向逆反应方向移动,升高温度平衡常数减小,即K(400℃)>K(500℃),
故答案为:常压下SO2的转化率已经很高,且增大压强时SO2的转化率提高不多,但成本增加较多;>;
②催化氧化时使用热交换器的原因是:移去反应中放出的热量,使反应后的气体降温并预热未反应的气体,
故答案为:移去反应中放出的热量,使反应后的气体降温并预热未反应的气体;
(6)A.NaOH溶液与SO2、微量的SO3和酸雾反应,测量的SO2含量偏高,故A错误;
B.Na2CO3溶液与SO2、微量的SO3和酸雾反应,测量的SO2含量偏高,故B错误;
C.硫酸尾气中只有SO2能被碘水氧化,溶液颜色由蓝色变为无色,根据碘水溶液的体积结合方程式计算SO2的含量,故C正确;
D.硫酸尾气中只有SO2能被酸性KMnO4溶液氧化,溶液颜色由紫红色变为无色,根据KMnO4溶液的体积结合方程式计算SO2的含量,故D正确,
故选:CD.
点评 本题考查制备方案设计工艺流程,涉及物质的分离提纯、基本操作、实验条件的选择、平衡常数影响因素、物质含量测定等,是对基础知识的综合应用,难度中等.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中混合气体的密度不变 | B. | 密闭容器中c(NH3):c(CO2)=2:1 | ||
| C. | 2v(NH3)=v(CO2) | D. | 密闭容器中氨气的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+2H2O?H2CO3+2NaOH | B. | NH3•H20?NH4++OH- | ||
| C. | CH3COOH?H++CH3COO- | D. | Na2SO3+H2O?NaHS03+NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图1装置构成锌--铜原电池 | |
| B. | 用图2装置选择裂化汽油提取溴水中溴 | |
| C. | 用图3装置灼烧碳酸钙制取少量氧化钙 | |
| D. | 用图4装置验证在该条件下铁钉发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有碳、氢两种元素组成的有机化合物称为烃 | |
| B. | 乙醛和乙酸都含有碳氧双键,二者都能发生加成反应 | |
| C. | 苯可以发生加成反应,但苯中不含有碳碳双键 | |
| D. | 乙醇和苯酚都含有羟基都能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可根据同周期元素的第一电离能变化规律,推出Al的第一电离能比Mg大 | |
| B. | 结构和组成相似的分子晶体,沸点随相对分子质量增大而升高,推出NH3的沸点低于PH3 | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据溶解度小的沉淀易向溶解度更小的沉淀转化的规律,推出在ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com