
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源:2016-2017学年甘肃省高一上第一次月考化学试卷(解析版) 题型:选择题
下列溶液中物质的量浓度为1 mol·L-1的是( )
A.将40 g NaOH固体溶解于1 L水中
B.将22.4 L氯化氢气体溶于水,配成1 L溶液
C.将1 L 10 mol·L-1的浓盐酸与9 L水混合
D.10 g NaOH固体溶解在水中,配制成250 mL溶液
查看答案和解析>>
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:实验题
某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4。某同学用15.0 g该废催化剂为原料,回收锌和铜。采用的实验方案如下,回答下列问题:
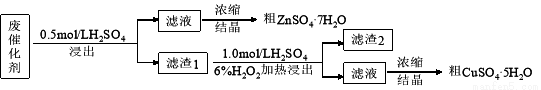
已知:ZnS与稀硫酸反应,且化合价不变; CuS既不溶解于稀硫酸,也不与稀硫酸反应
(1)在下列装置中,第一次浸出反应装置最合理的___________(填标号)。

(2)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法如下: 。
(提供的试剂:稀盐酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水)
(3)本实验要用到抽滤,设所用的洗涤剂为X,抽滤洗涤沉淀的操作 。
(4)写出第二次浸出的化学反应方程式 ,向盛有滤渣1的反应器中加H2SO4和H2O2溶液,应先加 。
(5)滤渣2的主要成分是 。浓缩、结晶得到硫酸锌晶体的主要仪器名称是 。
(6)某同学在实验完成之后,得到1.50 g CuSO4·5H2O,则铜的回收率为___________。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:选择题
X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20。下列判断正确的是
W | X | Y |
Z |
A.Z、X、Y形成的气态氢化物稳定性依次增强
B.四种元素形成的单质最多有6种
C.四种元素的原子半径:rZ>rY>rX>rW
D.四种元素中,X的氧化物对应的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:选择题
下列表示正确的是
A.HClO的结构式:H-O-Cl
B.X=11,右图表示钠原子的结构示意图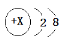
C.CCl4的电子式: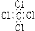
D.乙炔的最简式:C2H2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上第一次月考化学试卷(解析版) 题型:填空题
在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n (NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=_____________。
已知:K(300℃)>K(350℃),该反应是________热反应。
(2)下图中表示NO2的变化的曲线是____________。
用O2表示从0~2s内该反应的平均速率v=___________。

(3)能说明该反应已经达到平衡状态的是___________。
a、v(NO2)=2v(O2) b、容器内压强保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的浓度 d、选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上第一次月考化学试卷(解析版) 题型:选择题
在一密闭容器中发生反应:2X(g)+Y(g)  aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是
aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是

A.图甲,P1>P2,a < 3
B.图甲,T1<T2,Q >0
C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D.图乙,如果a=3, t2时表示向体系中加入了催化剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上第一次月考化学卷(解析版) 题型:实验题
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.他们只利用Al、 Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L).设计实验方案来研究影响反应速率的因素。
实验一:甲同学研究的实验报告如下表:

(1)该同学的实验目的是__________________
要得出正确的实验结论,还需控制的实验条件是_____________。
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验
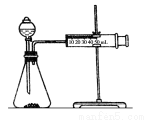
(2)乙同学在实验中应该测定的数据是_____________________。
(3)乙同学完成该实验应选用的实验药品是________________;
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是_____________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入________。
A.硫酸钾 B.硫酸锰 C.氯化钾 D.水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上10月月考化学试卷(解析版) 题型:选择题
锗(Ge)是第四周期第ⅣA族元素,处于元素周期表中金属区与非金属区的交界线上,下列叙述正确的是
A. 锗是一种金属性很强的元素 B. 锗的单质具有半导体的性能
C. 锗化氢(GeH4)稳定性很强 D. 锗酸(H4GeO4)是难溶于水的强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com