
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HA溶液与BOH 溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH 的关系如图所示。下列说法正确的是
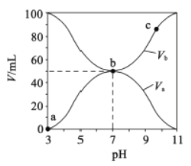
A. 由图可知BOH 一定是强碱 B. Ka(HA)=1×10-6mol/L
C. b点时,c(B-)=c(A-)=c(OH-)=c(H+) D. a→b过程中水的电离程度始终增大
【答案】D
【解析】
A.根据图知,酸溶液的pH=3,则c(H+)<0.1mol/L,说明HA是弱酸;碱溶液的pH=11,c(OH-)<0.1mol/L,则BOH是弱碱,A错误;
B.Ka(HA)=![]() mol/L,B错误;
mol/L,B错误;
C.b点是两者等体积混合溶液呈中性,c(B-)=c(A-),c(OH-)=c(H+),盐电离产生离子浓度远大于水电离产生的离子浓度,故离子浓度的大小为:c(B-)=c(A-)>c(OH-)=c(H+),C错误;
D.HA是弱酸,酸电离产生H+对水的电离平衡起抑制作用,在a→b过程中,酸被碱中和,溶液中酸电离产生的c(H+)减小,其对水的电离的抑制作用减弱,故水的电离程度始终增大,D正确。


科目:高中化学 来源: 题型:
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+ yB(g)![]() zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是

A. 图II所知反应xA(g)+yB(g) ![]() zC(g) △H<0,且a=2
zC(g) △H<0,且a=2
B. 200℃时,该反应的平衡常数为25
C. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol/(Lmin)
D. 当外界条件由200℃降温到100℃,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中进行,达到平衡状态的标志是
2NO+O2在恒容密闭容器中进行,达到平衡状态的标志是
①单位时间生成n mol O2,同时生成2n mool NO ②单位时间内生成n mol O2,同时生成2n mol NO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1 ④混合气体的颜色不再改变 ⑤混合气体的密度不再改变 ⑥混合气体的平均相对分子质量不再改变
A. ①③⑤ B. ②④⑥ C. ②③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红矾钠(Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:
4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g) ![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)如图为上述反应的浓度—时间图像,由图像判断反应进行至t2时刻时,改变的条件是_________________________,如图为上述反应的速率—时间图像,表示上述反应在t1时达到平衡, 在t2时因改变某个条件而使曲线发生变化。由图判断,t2时刻曲线变化的原因可能是________(填写序号)。
a.升高温度 b.加催化剂
c.通入O2 d.缩小容器体积

(2)工业上可利用上述反应的副产物CO2来生产甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①一定温度下,在容积为1L的密闭容器中,充入2 mol CO2和4 mol H2,一段时间后达到平衡,测得CH3OH的物质的量浓度为1mol/L,则该温度下此反应的平衡常数为_________,某时刻测得CO2、H2、CH3OH和H2O的物质的量分别为2mol,1mol,1mol,1mol,则这一时刻v(正)___________v(逆)
②在T1温度时,将1 mol CO2和3 mol H2充入一密闭容器中,充分反应达到平衡后,CO2转化率为α,则容器内的压强与起始压强之比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时 Na2S4转化为 Na2S。下列说法正确的是
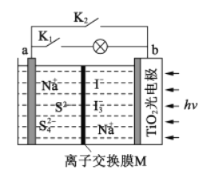
A. 充电时,太阳能转化为化学能,化学能又转化为电能
B. 放电时,a极为正极
C. 充电时,阳极的电极反应式为3I--2e-=I3-
D. M可以使用阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向V mL 0.1 mol/L氨水中滴加等物质的量浓度的稀H2SO4,测得混合溶液的温度和pOH [pOH=-lgc(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化),下列说法不正确的是
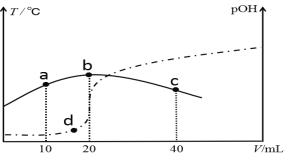
A. V =40
B. b点时溶液的pOH > pH
C. a、b、c三点由水电离的c(H+)依次减小
D. a、b、d三点对应NH3·H2O的电离常数:K(b)>K(d)>K(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.离子化合物中一定含离子键
B.离子化合物不可能只由非金属元素组成
C.离子化合物均能溶于水
D.熔化状态下能导电的物质一定是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com