
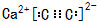 .
.
分析 A、B、C、D、E是前四周期原子序数依次增大的五种元素.A元素原子的核外电子数等于其电子层数,则A为H元素;B元素基态原子有三个能级且各能级电子数相同,核外电子排布式为1s22s22p2,故B为碳元素;A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,则D为O元素、G为H2O2、H为H2O;C的原子序数介于碳、氧之间,则C为N元素;E元素原子的K、L层电子数之和等于其M、N层电子数之和,原子核外电子数为(2+8)×2=20,则E为Ca,据此解答.
解答 解:A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,则A为H元素;B元素基态原子有三个能级且各能级电子数相同,核外电子排布式为1s22s22p2,故B为碳元素;A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,则D为O元素、G为H2O2、H为H2O;C的原子序数介于碳、氧之间,则C为N元素;E元素原子的K、L层电子数之和等于其M、N层电子数之和,原子核外电子数为(2+8)×2=20,则E为Ca.
(1)同周期自左而右电负性增大,C、N、O中电负性最大的元素为O元素,其基态原子核外电子排布式为1s22s22p4,核外电子排布式为:1s22s22p4,
故答案为:1s22s22p4;
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用电子云形象化描述,
B为碳元素,基态原子核外电子排布式为1s22s22p2,核外存在2对自旋相反的电子,
故答案为:电子云;2;
(3)某化合物晶胞结构如图所示,以顶点的E2+研究,与之等距且最近的E2+位于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,故晶体中E2+周围等距且最近的E2+有$\frac{3×8}{2}$=12个,
ED的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是:激发态的电子跃迁到低能级时,以光的形式释放能量,
E和B可形成的晶体的晶胞结构与NaCl晶体的相似,但该晶体中含有的哑铃形C22-的存在,使晶胞沿一个方向拉长,晶体中E2+的配位数为6,该化合物为CaC2,电子式为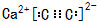 ,
,
故答案为:12;激发态的电子跃迁到低能级时,以光的形式释放能量;6;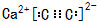 ;
;
(4)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子为H2O+.
①水分子间能形成“网”的原因是:水分子间存在氢键,
故答案为:水分子间存在氢键;
②由H分子释放出电子时产生的一种阳离子具有较强的氧化性,该阳离子与SO2水溶液反应离子方程式为:2H2O++SO2=4H++SO42-,
故答案为:2H2O++SO2=4H++SO42-.
点评 本题是对物质结构与性质的考查,涉及元素推断、电负性、核外电子排布、晶胞计算、氢键与信息给予题,推断元素是解题关键,是对学生综合能力的考查,难度中等.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体 Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体 Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 电子流向:A电极→用电器→B电极→电解质→A 电极 | |
| B. | 充电时,电极B与外接电源正极相连,电极反应式为Sx2--2e-=xS | |
| C. | 若用该电池在铁器上镀锌,则铁器应与B电极相连接 | |
| D. | 若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:
汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:| 化学键 | N≡N键 | O=O键 | N$\stackrel{←}{=}$O键 |
| 键能kJ/•mol-1 | 945 | 498 | 630 |
| 0min | 5min | 10min | 15min | 20min | |
| c(NO2) | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2) | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com