
【题目】下图是2SO3(g)![]() 2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
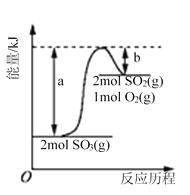
A. 该化学反应过程中既有能量的吸收又有能量的释放
B. 2SO3(g)![]() 2SO2(g)+O2(g) △H=-(a-b) kJ/mol
2SO2(g)+O2(g) △H=-(a-b) kJ/mol
C. 1 mol SO2的能量比1 mol SO3的能量高
D. 若某容器内有2 mol SO3充分反应,吸收(a-b) kJ热量
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】工业废气中氮氧化物(NO、NO2等,以通式NOx表示)是主要的大气污染物之一。
利用甲烷可消除NO2污染,CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和0.80molNO2,测得n(CH4)随时间变化的有关实验数据见下表:
N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和0.80molNO2,测得n(CH4)随时间变化的有关实验数据见下表:
组别 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 | 60 |
① | T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 | 0.10 |
② | T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 | 0.15 |
回答下列问题:
(1)组别①中,0~10min内NO2的平均降解速率为v(NO2)= ________________。
(2)由实验数据可知实验控制的温度T2_____T1(填“>”或“<”),请简述理由__________。
(3)组别②中,T2温度下40min时n(CH4)=________mol。该反应正反应为_______反应(填“吸热”或“放热”),理由是_____________________________。
(4)温度T1时CO2物质的量随时间的变化如下图,在图中画出温度T2时CO2物质的量随时间的变化曲线________。

(5)汽车尾气中含有CO和NOx等多种有害气体,若在汽车的排气管上安装一种催化转化装置,可使CO与NOx反应,生成两种无毒气体,则该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的描述不正确的是( )
A.用二氧化硅和水反应可以制得H2SiO3
B.SiO2可用于制造光导纤维
C.普通玻璃是以纯碱、石灰石和石英为原料制成的
D.盛装NaOH溶液的试剂瓶不用玻璃塞的原因是因为玻璃塞与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 甲基丙烯酰氯在一定条件下反应制得:

下列有关化合物X、Y 的说法正确的是
A. X 分子中所有原子一定在同一平面上 B. Y与Br2的加成产物分子中含有手性碳原子
C. X、Y均不能使酸性KMnO4溶液褪色 D. X→Y的反应为加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中Cl-、Br-、I-三者物质的量之比是1:2:3,通入一定量的Cl2,当反应完成后,该比值变为3:2:1,则反应的Cl2与原溶液中I-的物质的量之比是
A.1:2B.1:3C.1:4D.1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出H2O2电子式___;上述反应的热化学方程式______。
(2)已知H2O(l)=H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是____kJ。
(3)已知N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ·mol-1,N2H4(g)+O2(g)=N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程可以达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 配制0.010mol·L-1氨水 | 用量筒量取10.0mL5.00mol·L-1氨水于烧杯中,加入少量蒸馏水稀释,转移至500 mL容量瓶中定容 |
B | 探究SO2的还原性 | 向盛有2mLH2S溶液的试管中缓慢通入SO2,观察是否有沉淀生成 |
C | 制取并纯化溴苯 | 向FeBr3固体中慢慢加入Br2的苯溶液,充分反应后经水洗、Na2SO3溶液洗、水洗、分液、干燥,然后蒸馏 |
D | 比较两种黑色固体FeS和CuS的溶度积 | 向物质的量浓度相同的FeCl2和CuCl2的混合溶液中不断加入Na2S溶液,观察沉淀颜色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
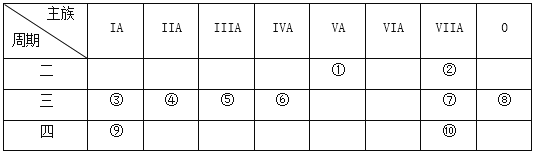
(1)在③~⑦中元素,原子半径最大的是_____________,其离子的结构示意图是__________________。
(2)表中的①~⑩中元素,非金属性最强的是_______,化学性质最稳定的是________,金属性最强的是__________,最高价氧化物的水化物的酸性最强的是(写该水化物的化学式)______________。
(3)⑦的氢化物的水溶液与①的氢化物的水溶液反应的离子方程式为___________________________。
(4)用一个化学反应说明⑦比⑩的单质化学性质活泼,写出反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2FeO4在水中不稳定,发生反应:4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如图所示。下列说法不正确的是
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如图所示。下列说法不正确的是

A. 由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱
B. 由图Ⅱ可知图中a>c
C. 由图Ⅰ可知温度:T1>T2>T3
D. 由图Ⅰ可知上述反应△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com