
【题目】一种带有多孔结构的镍铝合金对H2具有较强的吸附性,其高催化活性和热稳定性使得该镍铝合金被用于很多工业过程中和有机合成反应中。下图是以镍黄铁矿(主要成分为NiS、FeS等)为原料制备该镍铝合金的工艺流程图:

回答下列问题:
(1)Ni(CO)4中C、O化合价与CO中的C、O化合价相同,则Ni化合价为_______价。
(2)在空气中“煅烧”生成Ni2O3和Fe2O3,写出Fe2O3的化学方程式________________。
(3)操作“镍![]() Ni(CO)4
Ni(CO)4![]() 镍”的目的是__________。
镍”的目的是__________。
(4) Ni、Al高温熔融时,气体x的作用是___________。对“高温熔融”物冷却后,需要进行粉碎处理,粉碎处理的目的是________________。
(5)“碱浸”可以使镍产生多孔结构,从而增强对H2的吸附性,“浸出液”中的主要离子是_____________;“浸出液”中的铝元素可循环利用,写出回收“浸出液”中的铝元素,并制备“高温熔融”时的原料Al的流程:_____________(示例:CuO![]() Cu2+
Cu2+![]() Cu)。
Cu)。
【答案】 0 4FeS+7O2 ![]() 2Fe2O3+4SO2 提纯镍 保护Ni、Al,防止其被氧化 增大接触面积,提高“碱浸“的反应速率 Na+、AlO2-或[Al(OH)4]-、OH-
2Fe2O3+4SO2 提纯镍 保护Ni、Al,防止其被氧化 增大接触面积,提高“碱浸“的反应速率 Na+、AlO2-或[Al(OH)4]-、OH- ![]()
【解析】本题考查化学工艺流程,涉及化学反应原理知识的应用,(1)CO化合价代数和为0,而Ni(CO)4中C和O的价态与CO中的相同,因此Ni的化合价为0;(2)FeS煅烧生成Fe2O3和SO2,反应方程式为:4FeS+7O2![]() 2Fe2O3+4SO2;(3)目的是提纯Ni;(4)需要制备镍铝合金,高温熔融时容易被氧气氧化,即熔融时通入气体x,防止Ni、Al氧化;粉碎目的是增大接触面积,提高“碱浸”的反应速率;(5)高温熔融中含有铝,Al与NaOH反应,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,因此含有的离子是Na+、AlO2-、OH-;
2Fe2O3+4SO2;(3)目的是提纯Ni;(4)需要制备镍铝合金,高温熔融时容易被氧气氧化,即熔融时通入气体x,防止Ni、Al氧化;粉碎目的是增大接触面积,提高“碱浸”的反应速率;(5)高温熔融中含有铝,Al与NaOH反应,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,因此含有的离子是Na+、AlO2-、OH-;![]() 。
。


科目:高中化学 来源: 题型:
【题目】下图是中学教材中元素周期表的一部分,其中标出A-Q14种元素,试回答下列问题:[(1) (2)问用具体的元素符号或离子符号或化学式回答]
A | B | C | D | ||||||||||||||
E | F | G | H | I | J | K | L | ||||||||||
P | Q |
(1)在上表所列出的短周期元素中
①性质最不活泼的是_______;②原子半径最大的是_____(除稀有气体元素)
③形成的气态氢化物最稳定的是_______;
④最高价氧化物对应的水化物中酸性最强的是_______碱性最强的是_______。
⑤形成的阴离子还原性最弱的是_______,阳离子半径最小的是_______。
(2)用电子式表示F与D形成化合物的过程
________________________________________________________________________;
(3)设P的原子序数为Z,则F的原子序数为___________,Q的原子序数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、MnO2、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:
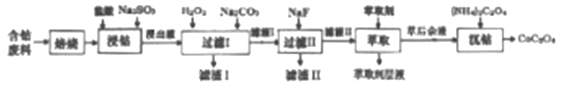
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等。
②部分阳离子一氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀时的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③Kap(MgF2)=7.35×10-11,Kap(CaF2)=1.05×10-10
回答下列问题:
(1)焙烧的目的是_________;浸钴过程中Co3+转化为Co2+,反应的离子方程式为_____________。
(2)加入H2O2的目的是__________,加入Na2CO3溶液,调pH至5.2,滤渣Ⅰ主要成分为__________。
(3)加入过量NaF溶液,可将Ca2+、Mg2+除去,若所得滤液中c(Ca2+)=1.0×10-5mol·L-1,则滤液中c(Mg2+)为_______________。
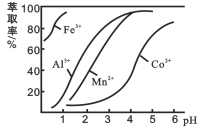
(4)萃取剂对金属离子的萃取率与pH的关系如下图所示。滤液Ⅱ中加入萃取剂的作用是_________;萃取时,溶液的pH需要控制在一定范围内才比较适宜,其pH范围约为__________。
(5)已知含钴废料中含Co2O3质量分数为a%,若取mg该含钴废料按照上述流程,理论上最多能制得CoC2O4的质量为__________g(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是( )

A.MgSO4
B.KAl(SO4)2
C.Al2(SO4)3
D.NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
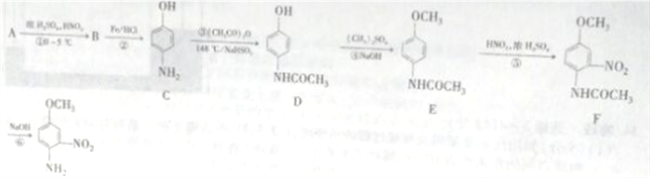
【题目】4-氨基-3硝基苯甲醚是合成类风湿关节炎治疗药物艾拉莫德的主要原料。4-氨基-3-硝基苯甲醚的合成路线如下:
已知: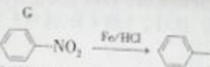 NH2(有弱碱性,易被氧化)
NH2(有弱碱性,易被氧化)
回答下列问题:
(1)A的结构简式为_______________,B的名称是_______________。
(2)反应②的反应类型是____________。
(3)C中官能团的名称是_________________。
(4)写出反应③的化学方程式:________________,反应③温度较高,若不加NaHSO3会导致反应混合体系的颜色明显不同,可能的原因是________________。
(5)写出反应⑥的化学方程式:______________________。
(6)H是E的同分异构体,则满足下列条件的结构有____种(不考虑立体异构),其中核磁共振氢谱中有4组峰,且峰面积比为1:2:2:6的结构简式为_____________。
①含有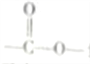 结构且能发生银镜反应
结构且能发生银镜反应
②N原子直接与苯环相连,且结构中不存在N—O键;
③苯环上有两个取代基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )
①它们所含的分子数目之比为1:1
②它们所含的氧原子数目之比为1:2
③它们所含的原子总数目之比为2:3
④它们所含的碳原子数目之比为1:1
A. ①和④ B. ②和③ C. ④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO![]() 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
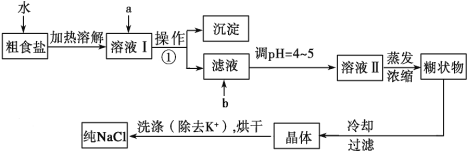
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳、稀盐酸。
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO![]() ,选出a所代表的试剂,按滴加顺序依次为____________________ (只填化学式)。
,选出a所代表的试剂,按滴加顺序依次为____________________ (只填化学式)。
(2)如何检验 SO![]() 是否沉淀完全 。
是否沉淀完全 。
(3)调节pH 的目的 ,试剂b是 (填名称)。
(4)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________,使用该试剂的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F基态原子的核外电子排布式为______________________。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是___________(用元素符号回答)。
(3)元素B的简单气态氢化物的沸点___________(填“高于”或“低于”)元素A的简单气态氢化物的沸点,其主要原因是______________________。
(4)由A、B、C形成的离子CAB与AC2互为等电子体,则CAB的结构式为___________。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为___________。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为___________。
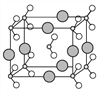
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ·mol-1
下列说法正确的是
A.CH3OH的燃烧热为192.9kJ·mol-1
B.反应①中的能量变化如图所示
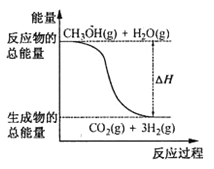
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com