
 如表是部分短周期元素的原子半径及常见化合价如表:
如表是部分短周期元素的原子半径及常见化合价如表:| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.099 | 0.074 | 0.102 |
| 常见化合价 | +2 | +3 | -1 | -2 | +6,-2 |
分析 D、E元素化合价都有-2价,且E有+6价,则D为O元素,E为S元素,A的化合价为+2价,且原子半径大于S,则A为Mg,B的化合价为+3价,且原子半径大于S,应为Al元素,C的化合价为-1价,结合原子半径关系可知C为Cl,以此解答(1)(2);
(3)镁和盐酸反应为放热反应,温度升高,反应速率增大.
解答 解:D、E元素化合价都有-2价,且E有+6价,则D为O元素,E为S元素,A的化合价为+2价,且原子半径大于S,则A为Mg,B的化合价为+3价,且原子半径大于S,应为Al元素,C的化合价为-1价,结合原子半径关系可知C为Cl,
(1)由以上分析可知E为S,位于周期表第三周期VIA族,C为氯元素,故答案为:第三周期VIA族;氯;
(2)B为Al,对应氧化物可与酸反应生成铝离子和水,反应的离子方程式为Al2O3+6H+=2Al3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O;
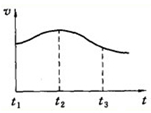
(3)镁和盐酸反应为放热反应,可使试管发烫,1gMg完全反应放出热量为QKJ,则1molMg与酸反应放出24QkJ热量,热化学方程式为Mg(s)+2HCl(aq)=MgCl2(aq)+H2(g)△H1=-24QKJ•mol-1,t1~t2时间内浓度逐渐减小,但速率逐渐增大,说明反应为放热反应,温度升高加快反应速率,
故答案为:镁与盐酸的反应是放热反应;Mg(s)+2HCl(aq)=MgCl2(aq)+H2(g)△H1=-24QKJ•mol-1;镁与盐酸反应放热,温度升高反应速率加快.
点评 本题考查原子结构以及元素周期律知识,为高频考点,侧重于学生的分析能力的考查,注意把握原子结构的递变规律,题目难度中等,答题时注意影响化学反应速率的因素.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为; ③能与水在一定条件下反应生成C ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为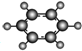 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与E反应生成相对分子质量为100的酯 |
| D | ①相对分子质量比C少2;②能由C氧化而成 |
| E | ①由C、H、O三种元素组成;②球棍模型为 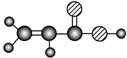 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.5% | B. | 8.5% | C. | 11.5% | D. | 12.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com