
下列物质中,不属于合成材料的是
A.塑料B.天然橡胶C.合成纤维D.合成橡胶
科目:高中化学 来源:2013-2014北京市西城区高三二模理综化学试卷(解析版) 题型:实验题
(13分)
利用某含铬废液[含较低浓度的Na2Cr2O7、Fe2(SO4)3]制备K2Cr2O7。
流程如下:
Ⅰ.用NaOH溶液调pH至3.6,产生红褐色沉淀,过滤;
Ⅱ.向滤液中加入Na2SO3,一定操作后分离出Na2SO4;
Ⅲ.将分离出Na2SO4后的溶液调pH约为5,得到Cr(OH)3沉淀;
Ⅳ.在KOH存在条件下,向Cr(OH)3中加入足量H2O2溶液,得到黄色溶液;
Ⅴ.向黄色溶液中加入物质A后,溶液变为橙红色,一定操作后得到K2Cr2O7固体;
Ⅵ.测定K2Cr2O7固体的纯度。
已知:Cr2O72-(橙红色)+H2O 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
(1)步骤Ⅰ中红褐色沉淀的化学式是 。
(2)步骤Ⅱ中加入Na2SO3的目的是 。
(3)步骤Ⅳ中反应的离子方程式是 。
(4)步骤Ⅴ中加入的物质A可以是 。(填序号)
a.KOH b.K2CO3 c.H2SO4 d.SO2
(5)步骤Ⅵ的操作是:取0.45 g K2Cr2O7产品配成溶液,酸化后滴入18.00 mL
0.50 mol/L的FeSO4溶液,恰好使Cr2O72-完全转化为Cr3+。产品中K2Cr2O7的纯度是 。(注:K2Cr2O7的摩尔质量为294 g/mol)
(6)向橙红色的K2Cr2O7溶液中,滴加Ba(NO3)2溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是 ,溶液pH变小的原因是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市西城区下学期高一年级期末考试化学试卷(解析版) 题型:实验题
(8分)利用下图装置验证同主族元素非金属性的变化规律。
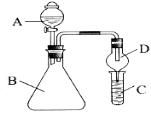
(1)若要证明非金属性:C1>I,A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾溶液,观察到C溶液中的现象是_________,即可证明。可用_________溶液吸收尾气。
(2)若要证明非金属性:C>Si,则在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,观察到C中溶液的现象是__________,即可证明。但有的同学认为盐酸具有挥发性,应用_________溶液除去。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市西城区下学期高一年级期末考试化学试卷(解析版) 题型:选择题
某化学反应中,反应物B的物质的量浓度在20s内,从2.0mol/L变成了1.0mol/L,则这20s内B的反应速率为
A.0.05mol/(L s) B.0.05 C.0.5mol/(L
s) B.0.05 C.0.5mol/(L s) D.0.05mol/L
s) D.0.05mol/L
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市海淀区高三第二学期二模理综化学试卷(解析版) 题型:选择题
一定条件下,反应:6H2 + 2CO2 C2H5OH + 3H2O的数据如下图所示。
C2H5OH + 3H2O的数据如下图所示。
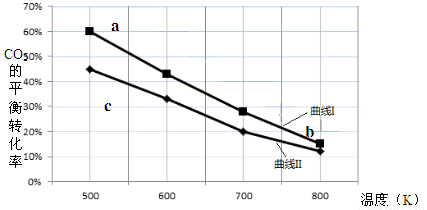

下列说法正确的是
A.该反应的△H > 0
B.达平衡时,v(H2)正 = v(CO2)逆
C.b点对应的平衡常数K值大于c点
D.a点对应的H2的平衡转化率为90 %
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市朝阳区高三二模理综化学试卷(解析版) 题型:简答题
(14分)
一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。
(1)加入铝粉产生H2,说明铝具有______(填“氧化性”或“还原性”)。
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在。
设计实验证实如下:
装 置 | 现 象 |
| ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色 ⅲ. 试管变热,溶液沸腾 |
① 盐酸溶解Al2O3薄膜的离子方程式是______。
② 根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
实 验 | 内 容 | 现 象 |
实验1 | 将湿润KI—淀粉试纸置于空气中 | 未变蓝 |
实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
a. 浅棕色气体是______。
b. 实验1的目的是_______。
c. 实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
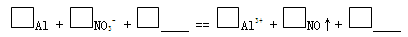
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在。
重新设计实验证实如下:
装 置 | 现 象 |
| ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,有刺激性气味 |
为确认“刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
① 刺激性气味的气体是______。
② 产生该气体的离子方程式是______。
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是______。
(5)实验结果证实:NO3‑在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物。习题中的无色溶液一定能大量存在的是Na+和OH-。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市第二学期期中测试高二化学试卷(解析版) 题型:填空题
(10分)写出下列反应的化学方程式,并指出反应类型:
(1)实验室制乙烯 ( )
(2)用甲苯制备TNT ( )
(3)苯酚和浓溴水的反应 ( )
(4)1,2-二溴乙烷与其足量氢氧化钠的乙醇溶液加热: ( )
(5)乙醛与银氨溶液的反应 ( )
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(福建卷解析版) 题型:填空题
(15分)铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
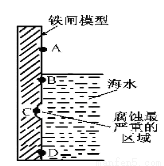
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
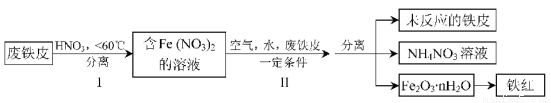
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com