
【题目】节约资源、保护环境,共同守护我们赖以生存的地球是每个人的责任。下列做法值得提倡的是
A.大力开采化石燃料
B.交通出行优先使用私家车
C.超市购物使用一次性塑料袋
D.回收利用垃圾中的有用资源
科目:高中化学 来源: 题型:
【题目】下列由乙烯推测丙烯的结构或性质中,正确的是
A. 分子中所有原子都在同一平面上 B. 不能发生氧化反应
C. 与HCl加成只生成一种产物 D. 能发生加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用于解释事实的化学用语中,不正确的是
A. Na2S溶液显碱性:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B. K2Cr2O7溶液中含有CrO42-:Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
C. 盛放NaOH溶液的试剂瓶不能用玻璃塞:2OH-+SiO2=SiO32-+H2O
D. 红热木炭遇浓硫酸产生刺激性气味气体:2H2SO4(浓)+C![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
①Al在氧气中燃烧生成Al2O3,将Al片改成Al粉
②Fe与稀硫酸反应制取H2时,改用98%浓硫酸
③Zn与稀硫酸反应制取H2时,滴加几滴CuSO4溶液
④在K2SO4与BaCl2两溶液反应时,增大压强
⑤2SO2+O2![]() 2SO3,升高温度
2SO3,升高温度
⑥Na与水反应时,增大水的用量
A. ①③⑤B. ②④⑥C. ①②③⑤D. ①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和1.01×105时,2N2O5(g)=4NO2(g)+O2(g) △H =+56.76kJ/mol ,该反应能自发进行的原因是
A.是吸热反应B.是放热反应
C.是熵减少的反应D.熵增大效应大于焓效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为______molL-1.
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______.
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400molL-1的稀盐酸.
①该学生需要量取______mL上述浓盐酸进行配制.
②所需的实验仪器有:胶头滴管、烧杯、量筒、玻璃棒,配制稀盐酸时,还缺少的仪器有_________________________.
(4)①假设该同学成功配制了0.400molL-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取______mL盐酸.
②假设该同学用新配制的盐酸中和含0.4gNaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是___________.
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活中的物质与其有效成分的化学式、用途的对应关系中,不正确的是( )
选项 | A | B | C | D |
生活中的物质 | 84消毒液 | 小苏打 | 复方氢氧化铝片 | 食盐 |
有效成分的化学式 | Ca(OH)2 | NaHCO3 | Al(OH)3 | NaCl |
用途 | 做消毒剂 | 做发酵粉 | 做抗酸药 | 做调味品 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2![]() 2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C![]() Pb+CO↑;PbO+CO
Pb+CO↑;PbO+CO![]() Pb+CO2。
Pb+CO2。
下列说法正确的是
A. 浮选法富集方铅矿的过程属于化学变化
B. 将1mol PbS冶炼成Pb理论上至少需要6g碳
C. 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
D. 整个冶炼过程中,制取1mol Pb共转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍。A的一种原子中,质量数与质子数之差为零。D元素原子的最外层电子数为m,次外层电子数为n。E元素原子的L层上电子数为(m+n),M层上电子数为![]() 。请回答下列问题:
。请回答下列问题:
(1)B元素是________,D元素在周期表中的位置是________。
(2)C与E形成的化合物E3C属于________(填“原子”“离子”或“分子”)晶体。
(3)由A、D、E元素组成的化合物中存在的化学键类型是________。
(4)写出一个E和D形成的化合物与水反应的离子方程式:_________________________。
(5)已知:甲+H2O→丙+丁,该反应不是氧化还原反应。若甲是由N和Cl元素组成的化合物,其分子结构模型如下图所示,丙具有漂白性。丁与H2O有相同的电子总数,则丁的电子式为_________________。
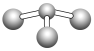
(6)与D同主族且上下相邻的元素M、N,原子电子层数M>N>D,三种元素的氢化物的稳定性由大到小的顺序是________________________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com