
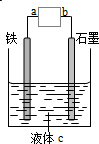
| A. | a、b接电流表,该装置为原电池 | |
| B. | a、b接直流电源,该装置为电解池 | |
| C. | a、b接直流电源,铁可能不易被腐蚀 | |
| D. | a、b接电流表或接直流电源,铁都可能是负极 |
分析 A.a、b接电流表,若液体c为非电解质溶液,则不能形成原电池;
B.若液体c为非电解质溶液,则不能电解;
C.Fe与负极相连作阴极时被保护;
D.接直流电源时,该装置可能为电解池没有正负极.
解答 解:A.a、b接电流表,若液体c为非电解质溶液,不满足原电池的构成条件,不能形成原电池,故A错误;
B.若液体c为非电解质溶液,溶液不导电,所以不能电解,即不是电解池,故B错误;
C.若该装置是电解池,Fe与负极相连作阴极时被保护,即铁可能不易被腐蚀,故C正确;
D.接直流电源时,该装置可能为电解池没有正负极,Fe作阴极或阳极,故D错误.
故选C.
点评 本题考查了电解原理、原电池原理的分析判断,电极分析判断是解题关键,题目难度中等,注意液体c不一定是电解质溶液.


科目:高中化学 来源: 题型:解答题
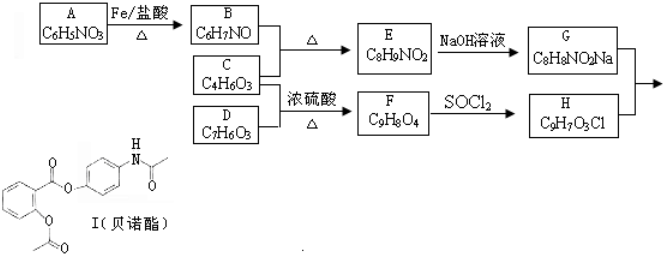
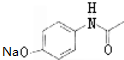 .
. (其中的三种).
(其中的三种). 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件).示例:CH4$→_{光照}^{2Cl}$CH3Cl$→_{△}^{NaOH溶液}$CH3OH.
的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件).示例:CH4$→_{光照}^{2Cl}$CH3Cl$→_{△}^{NaOH溶液}$CH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置可干燥、收集并吸收多余的NH3 | |
| B. |  装置除去CO2中含有的少量HCl | |
| C. |  装置可以制备大量的乙炔气体 | |
| D. |  装置不添加任何仪器即可检查气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氢气完全燃烧生成液态水放出的热量小于241.8KJ | |
| B. | 1mol水蒸气完全分解成氢气与氧气,需吸收241.8kJ热量 | |
| C. | 2mol氢气与1mol氧气的总能量小于2mol 水蒸气的总能量 | |
| D. | 2mol氢氢键和1mol氧氧键拆开所消耗的能量大于4mol氢氧键成键所放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
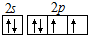 .
.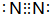 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
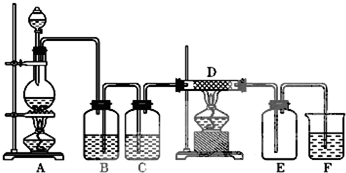
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO3>H2CO3 | B. | 熔沸点:HF>HCl | ||
| C. | 碱性:NaOH>Al(OH)3 | D. | 热稳定性:Na2CO3>CaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com