
完成下列离子方程式:
(1)钠与水反应:_______________________________________________________________。
(2)氯气通入水中:_____________________________________________________________。
(3)向氢氧化钠溶液中通入少量CO2:
________________________________________________________________________。
(4)碳酸钙中滴入醋酸溶液:
________________________________________________________________________。
(5)铝片投入氢氧化钠溶液:
________________________________________________________________________。
(6)氯化铝溶液中加足量碳酸氢钠溶液:
________________________________________________________________________。
(7)FeCl3溶液与Cu反应:
________________________________________________________________________。
(8)酸性硫酸亚铁溶液中加入过氧化氢溶液:
________________________________________________________________________。
(9)实验室用MnO2与浓盐酸制取Cl2:
________________________________________________________________________。
(10)NO2溶于水:_____________________________________________________________。
答案 (1)2Na+2H2O===2Na++2OH-+H2↑
(2)Cl2+H2OH++Cl-+HClO(或Cl2+H2O===H++Cl-+HClO)
(3)CO2+2OH-===CO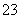 +H2O
+H2O
(4)CaCO3+2CH3COOH===Ca2++2CH3COO-+CO2↑+H2O
(5)2Al+2OH-+2H2O===2AlO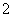 +3H2↑
+3H2↑
(6)Al3++3HCO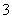 ===Al(OH)3↓+3CO2↑
===Al(OH)3↓+3CO2↑
(7)2Fe3++Cu===Cu2++2Fe2+
(8)2Fe2++H2O2+2H+===2Fe3++2H2O
(9)2Cl-+4H++MnO2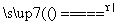 Cl2↑+Mn2++2H2O
Cl2↑+Mn2++2H2O
(10)3NO2+H2O===2H++2NO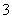 +NO
+NO


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
反应 A+B—→C(ΔH<0)分两步进行:①A+B—→X (ΔH >0),②X—→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
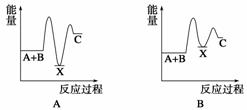
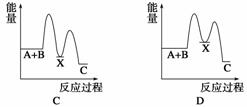
查看答案和解析>>
科目:高中化学 来源: 题型:
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成。(提示:铝与氧化铁发生的反应称为铝热反应)
②另取20g A全部溶于0.15L 6.0mol·L-1盐酸中,得溶液C。
③将①中得到的单质B和溶液C反应,放出气体1.12L(标准状况下),同时生成溶液D,还残留固体B。
④用KSCN溶液检验时,溶液D不变色。
(1)反应①的产物中的单质B是________。
(2)②所发生各反应的化学方程式是:
_____________________________________________________________。
(3)若溶液D的体积仍为0.15L,则该溶液中
c(Mg2+)为________ ,c(Fe2+)为________(保留小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬烯是一种食用香料,其结构简式如图,有关柠檬烯的分析错误的是
A.在一定条件下,1mol柠檬烯可与2molH2完全加成
B.柠檬烯的一氯代物有7种
C.在一定条件下,柠檬烯可发生加成、取代、氧化、还原反应
D.柠檬烯分子中所有碳原子不可能都在同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求回答下列问题:
⑴常温下,向VL 0.1mol/L的醋酸溶液中加水稀释,下列说法中正确的是 (填字母)
A.溶液中导电粒子的数目将减少 B.由水电离的c(H+)浓度将减小
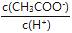
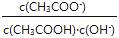
C.溶液中不变 D.溶液中 将减小
E.醋酸的电离程度将增大,c(H+)也增大
⑵①常温下,将0.1mol/L的硫酸V1mL与0.1mol/LNaOH溶液V2mL混合后,溶液的pH=1则V1:V2= (忽略溶液体积的变化)。
②常温下,若溶液由pH=3的盐酸V1mL与pH=11的某碱BOH溶液V2mL混合而得,则下列假设和结论都正确的是 (填字母)
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,则混合后溶液的pH一定等于7
C.若V1=V2,则混合后一定有:c(Cl-)>c(B+)>c(H+)>c(OH-)
D.混合后的溶液中一定有c(B+)+c(H+)=c(Cl-)+c(OH-)
⑶常温下,浓度均为0.1mol/L的五种溶液的pH如下表所示:
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①写出向NaClO溶液中通入少量CO2的离子方程式 。
②将浓度均为0.01mol/L下列溶液分别加水稀释10倍,pH变化最小的是 (填字母)
A.HCN B.HClO C.H2CO3 D.CH3COOH
③常温下,等浓度的醋酸与醋酸钠组成的混合溶液pH=6,则c(CH3COO-)-c(CH3COOH)=
(填准确数值)。
⑷已知常温下Ksp(AgCl)=1.0×10-10,Ksp (CH3COOAg)=9.0×10-4。常温下,CH3COOAg若要在NaCl溶液中开始转化为AgCl沉淀,则NaCl的浓度必须不低于 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子能在溶液中大量共存的是( )
A.Na+、NH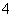 、CO
、CO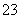 、Br-
、Br-
B.Fe2+、H+、NO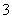 、Cl-
、Cl-
C.Al3+、Ca2+、HCO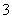 、SO
、SO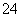
D.Fe3+、Cu2+、NO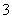 、OH-
、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是( )
A.Cl2通入NaOH溶液:Cl2+OH-===Cl-+ClO-+H2O
B.NaHCO3溶液中加入稀HCl:CO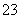 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O===AlO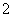 +4NH
+4NH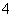 +2H2O
+2H2O
D.Cu溶于稀HNO3:3Cu+8H++2NO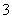 ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
有一瓶澄清溶液,其中可能含有NH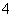 、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO
、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO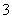 、CO
、CO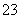 、SO
、SO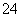 中的几种。取该溶液进行以下实验。
中的几种。取该溶液进行以下实验。
(1)填写表中空白:
| 实验步骤 | 肯定不存在的离子 |
| ①用pH试纸检验,溶液呈强酸性 | |
| ②取出部分溶液,加入少量CCl4及数滴新制的氯水,经振荡、静置后CCl4层呈紫红色 | |
| ③另取部分溶液,向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中及滴加完毕后,均无沉淀产生 | |
| ④取③中的部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝 | |
| ⑤另取③中的部分碱性溶液,向其中加入Na2CO3溶液,有白色沉淀产生 |
(2)根据以上事实,该溶液中肯定存在的离子是________。
(3)写出实验②、④、⑤中反应的离子方程式:
实验②________________________________________________________________________;
实验④________________________________________________________________________;
实验⑤________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定浓度的FeCl3溶液中,存在如下水解平衡:Fe3++3H2O Fe(OH)3+3H+,在此溶液中滴入饱和的FeCl3溶液,下列说法中正确的是( )
Fe(OH)3+3H+,在此溶液中滴入饱和的FeCl3溶液,下列说法中正确的是( )
A.水解平衡向正反应方向移动 B.水解平衡向逆反应方向移动
C.溶液中H+浓度不变 D.Fe3+的水解程度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com