
【题目】叠氮化钠(NaN3)是一种无色无味的晶体,他在医药、炸药、照相药剂、树脂及农药合成等中应用广泛,它又是汽车安全气囊最理想的气体发生原料。有关他的制取以及纯度测定实验如下,试分析并回答:
(1)①方法一,液氨法,液氨与金属钠反应生成NaNH2,再与笑气反应(NaNH2+N2O→NaN3+NaOH+Y),Y的常用检测检验方法是_____________;
②方法二,水合肼法,N2H4H2O+NaOH+C2H5ONO= NaN3+C2H5O H+3H2O,C2H5ONO即亚硝酸乙酯,可用乙醇、硫酸与NaNO2来制取,其中C2H5ONO从组成看,可用另一种同分异构体代替:___________(写名称);由此有人提出用N2H4与NaNO2在一定条件下直接制取NaN3,其化学方程式是__________;
③方法三,尿素法,尿素[CO(NH2)2]与硝酸、浓硫酸、锌电解还原、NaNO2及脱水等经一系列反应后生成NH2CON3,后者再与NaOH反应,即发生NH2CON3+NaOH→NaN3+Y+Z+H2O,生成NaN3,则Z的俗名是_____。
(2)采用如下装置测定NaN3纯度:准确称量1.40克NaN3样品,与NaClO反应产生N2并放出热量(注:杂质不与NaClO反应)。
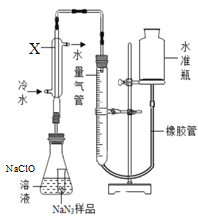
①使小试管中的NaN3样品与NaClO溶液接触的操作是____________;该反应的化学方程式是___________;
②仪器X的名称是____________,使用冷水冷凝的目的是冷却生成的气体及____;反应前应将液面调节到量气筒的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是__________;
③常温下量气筒读数为672mL(N2的密度为1.25 gL-1)。则该NaN3样品的纯度是_______。
【答案】用湿润的红色石蕊试纸检验,试纸变蓝色 硝基乙烷 ![]() 纯碱或苏打 将锥形瓶倾斜
纯碱或苏打 将锥形瓶倾斜 ![]() (直形)冷凝管 除去生成的气体中的水蒸气 调节量气管,使两侧的液面保持水平 约92.9%
(直形)冷凝管 除去生成的气体中的水蒸气 调节量气管,使两侧的液面保持水平 约92.9%
【解析】
(1)①根据元素守恒,反应前后原子的种类与数目保持不变判断气体为氨气,结合氨气的检验方法回答;
②分子式相同,结构不同的有机物互为同分异构体;根据酯类水解反应与已知反应利用盖斯定律的理论分析化学方程式;
③依据元素守恒规律判断化学方程式;
(2)①根据仪器的使用方法分析;结合氧化还原反应的规律书写离子方程式;
②根据仪器的构造与用途回答;反应可能产生水蒸气,使用冷水冷凝可除去生成的气体中的水蒸气;量气管读数前,需要平衡压强;
③先根据体积和密谋计算氮气的体积,再利用关系式2NaN3→3N2计算NaN3样品的纯度。
(1)①NaNH2与N2O反应可生成NaN3、NaOH和NH3,则Y为NH3,用湿润的红色石蕊试纸检验,若试纸变蓝色,则该气体为NH3,故答案为:用湿润的红色石蕊试纸检验,试纸变蓝色;
②C2H5ONO与硝基乙烷互为同分异构体,可用硝基乙烷来代替;亚硝酸乙酯在碱性条件下可发送水解生成乙醇与亚硝酸钠,因此N2H4H2O+NaOH+C2H5ONO= NaN3+C2H5OH+3H2O可用N2H4与NaNO2在一定条件下直接制取NaN3,变换后的化学方程式为:![]() ,故答案为:硝基乙烷;
,故答案为:硝基乙烷;![]() ;
;
③NH2CON3+NaOH→NaN3+Y+Z+H2O,Y为NH3,生成的Z为Na2CO3,其俗名为纯碱或苏打;
(2)①根据图示装置可知,将锥形瓶倾斜可使小试管中的NaN3样品与NaClO溶液接触,NaClO具有氧化性,可将NaN3转化为N2,自身被还原为NaCl,则反应的化学方程式为:![]() ,故答案为:将锥形瓶倾斜;
,故答案为:将锥形瓶倾斜;![]() ;
;
②图示X为(直形)冷凝管;反应可能产生水蒸气,使用冷水冷凝的还可除去生成的气体中的水蒸气;量气管读数前,需要调节量气管使两侧的液面保持水平,确保气体压强与外界大气压强相等,故答案为:(直形)冷凝管;除去生成的气体中的水蒸气;调节量气管,使两侧的液面保持水平;
③生成氮气的质量为![]() =0.84g,
=0.84g,
设NaN3样品的纯度X,
2NaN3 ![]() 2Na+3N2↑
2Na+3N2↑
130 84
x1.40g 0.084g
![]() 解得:x
解得:x![]() 92.9%,故答案为:约92.9%。
92.9%,故答案为:约92.9%。


科目:高中化学 来源: 题型:
【题目】将CO2转化成有机物可有效实现碳循环,如下CO2转化成有机物的反应中,原子利用率最高的是( )
A.6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
B.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
C.CO2+CH4![]() CH3COOH
CH3COOH
D.2CO2+6H2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔在不同条件下可以转化成许多化合物,如图所示,下列叙述正确的是( )
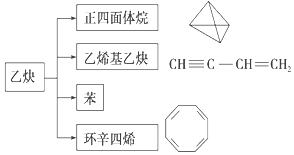
A. 正四面体烷的二氯代物只有1种
B. 乙炔生成乙烯基乙炔是取代反应
C. 由乙炔制得的四种有机物的含碳量不同
D. 苯乙烯与环辛四烯分子式不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙醇的催化氧化,某教师设计了如图所示装置,试回答以下问题:

(1)实验开始时打开a、b处活塞,B、E、F及各处导管均无堵塞现象,发现分液漏斗中的双氧水只流下少许后便停止流下,可能原因是:______,C装置中热水的作用是:_____。
(2)从M管中可观察到的现象:交替通入氧气和乙醇气体,铜丝交替出现____的颜色变化。写出M中发生反应的总方程式:__________。
(3)用Ag(NH3)2OH验证乙醇催化氧化产物的化学方程式为_________。
(4)乙醇除了能发生催化氧化,还可以发生消去反应,乙醇发生消去反应的条件是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体有单质、二元化合物、三元化合物等之分,其中三元半导体CuAlO2(或Cu2Al2O4)的制取,常采用CuO与Al2O3或Al(OH)3共热的方法。试分析并回答:
(l)试完成如下化学方程式:
_______CuO+_______ Al2O3![]() _______Cu2Al2O4+_______ ↑
_______Cu2Al2O4+_______ ↑
(2)上述反应能发生的理由主要是_____________。
(3)Al(OH)3有碱式和酸式两种电离方式,若25℃时,其酸式电离为Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13,则入Al(OH)3+OH-
AlO2-+H++H2O K=2.0×10-13,则入Al(OH)3+OH-![]() AlO2-+2H2O的平衡常数K’=_______(列式并计算)。该反应的△H_______(填“<”“>”或“=”)0。
AlO2-+2H2O的平衡常数K’=_______(列式并计算)。该反应的△H_______(填“<”“>”或“=”)0。
(4)经实验测定,“AlO2-” 的形式应该是[Al(OH)4]-,则AlCl3溶液与Na[Al(OH)4]溶液作用的离子方程式是_________________。
(5)用石墨电极电解Na[Al(OH)4] 溶液是制取高品质用Al(OH)3的方法之一。该电解反应的离子方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在医药、照相、橡胶、染料、气象等许多领域都具有广泛的用途,海洋中虽然含碘的浓度相当小,每升海水中平均含碘0.06mg,但海洋里碘的总储量仍很惊人——9.3×1010t,比陆地上要多得多。一般生长在海底的海带含碘0.3%~0.5%,有的可达1%,比海水中碘的浓度高出十几万倍!海藻中含有丰富的碘元素(以I-形式存在)。实验室提取碘的流程如下:
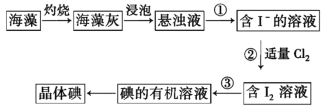
(1)实验操作①的名称是_________,实验操作③所用主要仪器名称为____________,实验②发生的离子反应方程式为 ___________________。
(2)提取碘的过程中,可供选择的有机试剂是___________(填序号)。
A.四氯化碳(沸点77℃) B.酒精(沸点78℃) C.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消耗此杂质,使碘全部游离出来,应加入适量_________(填序号)溶液,反应的离子方程式为___________。
A.KIO3 B.HClO C.Br2 D.KI
(4)为使从含碘有机溶液中提取碘并回收溶剂,采用水浴加热蒸馏(如图所示)。请指出图中实验装置除未加沸石外的错误之处(有处填几处,下列空白可不填满,也可补充)。
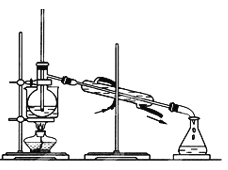
①____________
②____________
③____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)3C(g)+nD(g),开始时A为3mol,B为6mol,5min末时测得C的物质的量为3mol,用D表示的速率为0.1mol·L-1·min-1。计算:
(1)5min末A物质的量浓度为______。
(2)前5min内用B表示的化学反应速率为v(B)为______。
(3)化学方程式中n=_____。
(4)此反应在四种不同情况下的反应速率分别为:
① v(A)=4 mol·L-1·min-1
② v(B)=6 mol·L-1·min-1
③ v(C)=4.5 mol·L-1·min-1
④ v(D)=5 mol·L-1·min-1
其中反应速率最大的是______。
(5)A 5min末时的转化率为______。
(6)下列描述中,为该反应达到平衡的标志的是___。
A.v正(A)=v逆(B)
B.n(A): n(B): n(C)=1: 2: 3
C.反应混合物中各组分物质的量浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
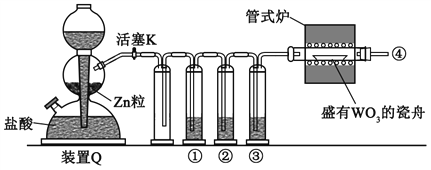
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com