
【题目】向含S2﹣、Fe2+、Br﹣、I﹣各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系图正确的是( )
A.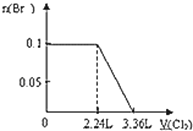 B.
B.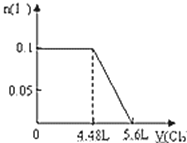
C.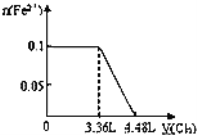 D.
D.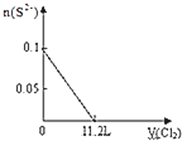
【答案】C
【解析】
离子还原性S2->I->Fe2+>Br-,故首先发生反应S2-+Cl2=S↓+2Cl-,再发生反应2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积。
A、Br-的物质的量与Cl2的体积的关系图,根据分析,S2-、I-、Fe2+完全被氧化的时候,Br-才被氧化。根据电荷守恒,S2-被氧化生成S,化合价升高2价,I-被氧化得到I2,化合价升高1价,Fe2+被氧化得到Fe3+化合价升高1价,则S2-、I-、Fe2+完全氧化时,转移的电子的物质的量为0.1×(2+1+1)=0.4mol,1molCl2得到2mol电子生成2molCl-,先得到0.4mol电子,则氯气体积为0.4mol÷2×22.4L/mol=4.48L,即溴离子开始反应时氯气的体积为4.48L,由2Br-+Cl2=Br2+2Cl-可以知道,0.1molBr-完全反应消耗0.05mol氯气,故溴离子完全反应时消耗氯气的体积为4.48L+ 0.05mol×22.4L/mol=5.6L,图象中氯气的体积不符合,故A错误;
B、I-的物质的量与Cl2的体积的关系图,0.1mol S2-完全反应后,才发生2I-+Cl2=I2+2Cl-,0.1mol S2-完全反应需要消耗0.1mol氯气,故开始反应时氯气的体积为2.24L,0.1mol I-完全反应消耗0.05mol氯气,故0.1mol I-完全反应时氯气的体积为0.15mol×22.4L/mol=3.36L,图象中氯气的体积不符合,故B错误;
C、Fe2+的物质的量与Cl2的体积的关系图,0.1mol S2-完全反应需要消耗0.1mol氯气,0.1molI-完全反应消耗0.05mol氯气,故亚铁离子开始反应时氯气的体积为0.15mol×22.4L/mol=3.36L,由2Fe2++Cl2=2Fe3++2Cl-可以知道,0.1mol Fe2+完全反应消耗0.05mol氯气,故Fe2+完全时消耗的氯气体积为0.2mol×22.4L/mol=4.48L,图象与实际符合,故C正确;
D、由S2-+Cl2=S+2Cl-,可以知道,0.1mol S2-完全反应需要消耗0.1mol氯气,标准状况下的Cl2的体积为0.1mol×22.4L/mol=2.24L,图象中氯气的体积不符合,故D错误;
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有___种;基态铜原子的价电子排布式为___。
(2)N和O中第一电离能较小的元素是__;SO42-的空间构型___。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为___,H2O2难溶于CC14,其原因为___。
(4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为___。
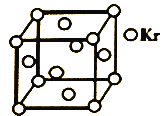
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏加德罗常数的值,晶胞边长为540pm,则该晶体的密__g/cm3(只列式不计算,Kr摩尔质量为84g·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年我国科研人员研制出一种室温“可呼吸”NaCO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如右图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是:

A.“吸入”CO2时,钠箔为正极
B.“呼出”CO2时,Na+向多壁碳纳米管电极移动
C.“吸入”CO2时的正极反应:4Na+ + 3CO2 + 4e—= 2Na2CO3 + C
D.标准状况下,每“呼出”22.4LCO2,转移电子数为0.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴加少量NaOH溶液,无明显变化;(2)继续滴加NaOH溶液,有白色胶状沉淀生成;(3)滴加过量的NaOH溶液,白色胶状沉淀明显减少。实验小组经定量分析,得出如图所示沉淀的物质的量与滴加NaOH溶液体积的关系。下列说法错误的是( )

A. 该未知溶液中至少含有3种阳离子
B. NaOH溶液的物质的量浓度为5 mol·L-1
C. 若另一种离子为二价阳离子,则a=10
D. 若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不导热的密闭反应器中,只发生两个反应:
A(g)+B(g)![]() 2C(g) ΔH1<0;
2C(g) ΔH1<0;
X(g)+3Y(g)![]() 2Z(g) ΔH2>0。
2Z(g) ΔH2>0。
进行相关操作且达到化学平衡后(忽略体积改变所做的功),下列叙述错误的是
A. 等压时,通入惰性气体,C的物质的量不变
B. 等压时,通入Z气体,反应器中温度升高
C. 等容时,通入惰性气体,各反应速率不变
D. 等容时,通入Z气体,Y的物质的量浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B.CaCO3(s)加热分解生成CaO(s)和CO2(g),△S<0
C.将体积增大为原来的2倍,再次达到平衡时,气体的密度变小
D.保持容器体积不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上氟气可作为火箭燃料中的氧化剂。1886年法国化学家![]() 通过电解氟氢化钾
通过电解氟氢化钾![]() 的氟化氢无水溶液第一次制得氟气。已知:
的氟化氢无水溶液第一次制得氟气。已知:![]() ,制备氟气的电解装置如下图所示。下列说法错误的是( )
,制备氟气的电解装置如下图所示。下列说法错误的是( )

A. 钢电极与电源的负极相连
B. 氟氢化钾在氟化氢中可以电离
C. 阴极室与阳极室必须隔开
D. 电解过程需不断补充的X是KF。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.电解精炼铜时,若转移2NA个电子,则阳极减少的质量为64g
B.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
C.![]() 在常温下能自发进行,则该反应的△H>0
在常温下能自发进行,则该反应的△H>0
D.常温下,![]() 。欲使溶液中
。欲使溶液中![]() ,需调节溶液的
,需调节溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为_____.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL 蒸馏水,振荡,恢复至室温,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_____.
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
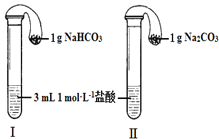
①两试管中均产生气体,_____(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是_____.
a 装置 I的气球体积较大 b 装置Ⅱ的气球体积较大
c 装置 I的气球体积等于装置Ⅱ的气球体积 d 无法判断
(4)同学们将两种固体分别配制成0.5molL﹣1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2mL Na2CO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32﹣浓度较大,能与CaCl2发生反应__________(写离子方程式). |
操作2:向2mL NaHCO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 无白色沉淀 | Na2CO3溶液中的CO32﹣浓度很小,不能与CaCl2发生反应。 |
操作1反应的离子方程式为________________,实施试验后,发现操作2的现象与预测有差异,产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com