
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为_________________________________________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________________________________________。
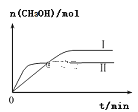
(3)①CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___________________KⅡ(填“>”或“=”或“<”)。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___________________KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为______________________。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是______________。
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
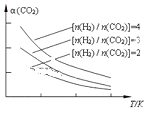
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图,若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图,若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
【答案】Fe2O3(s)+3CO(g)=2Fe(s)+ 3CO2(g)△H=-28.5KJ/mol CO-2e-+4OH-=CO32-+2H2O > 0.4<c≤1 bd 不变 <
【解析】
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol,②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol,根据盖斯定律有①-②×3可得;
(2)根据原电池负极失去电子发生氧化反应结合电解质环境可得;
(3)①Ⅱ比Ⅰ的甲醇的物质的量少,根据K= ![]() 判断;
判断;
②根据平衡三段式求出甲中平衡时各气体的物质的量,然后根据平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行来判断范围;
③根据化学平衡状态的特征分析;
(4)由图可知,投料比![]() 一定,温度升高,CO2的平衡转化率减小,根据温度对化学平衡的影响分析可得。
一定,温度升高,CO2的平衡转化率减小,根据温度对化学平衡的影响分析可得。
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol,②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol,根据盖斯定律有①-②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
(2)CO与空气可设计成燃料电池(以KOH溶液为电解液),负极电极反应为:CO-2e-+4OH-=CO32-+2H2O;
(3)①Ⅱ比Ⅰ的甲醇的物质的量少,则一氧化碳和氢气的物质的量越多,根据K= ![]() 可知,平衡常数越小,故KⅠ>KⅡ;
可知,平衡常数越小,故KⅠ>KⅡ;
②
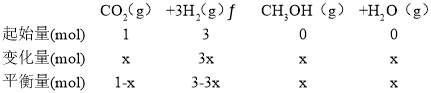
甲中平衡后气体的压强为开始时的0.8倍,即(4-2x)÷4=0.8,解得x=0.4mol;依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4mol<n(c)≤1mol;
③a.反应在恒压容器中进行,容器中压强始终不变,故a错误;
b.反应开始,减少,H2的体积分数不变时,反应平衡,故b正确;
c.c(H2)与c(CH3OH)的关系与反应进行的程度有关,与起始加入的量也有关,所以不能根据它们的关系判断反应是否处于平衡状态,故c错误;
d.根据ρ=![]() ,气体的质量不变,反应开始,体积减小,容器中密度不变时达到平衡,故d正确;
,气体的质量不变,反应开始,体积减小,容器中密度不变时达到平衡,故d正确;
e.C=O断裂描述的正反应速率,H-H断裂也是描述的正反应速率,故e错误;
故答案为:bd;
(4)由图可知,投料比![]() 一定,温度升高,CO2的平衡转化率减小,说明温度升高不利于正反应,即正反应为放热反应△H<0;K只与温度有关,温度不变,提高投料比
一定,温度升高,CO2的平衡转化率减小,说明温度升高不利于正反应,即正反应为放热反应△H<0;K只与温度有关,温度不变,提高投料比![]() ,K不变。
,K不变。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】有机物F是一种临床常用的基本药物,有广泛的用途,其合成路线如下:
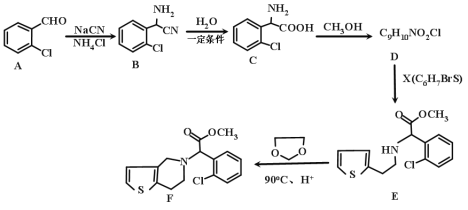
(1)A的化学名称是________,B的分子式是_____________。
(2)C中含氧官能团的名称为________。)
(3)请写出 C→D 的化学方程式为___________,其反应类型是________。
(4)G是C的同系物,且少一个碳原子,则G的结构有_____种。
(5)X的结构简式为___________。
(6)已知: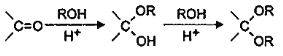 ,则由乙烯、甲醛为有机原料制备化合物
,则由乙烯、甲醛为有机原料制备化合物![]() ,请写出合成路线________(无机试剂任选)
,请写出合成路线________(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E四种元素,它们原子的核电荷数均小于18,且依次递增,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D的最外层电子数是次外层电子数的3倍;E的单质是用途最广泛的半导体材料。试推断它们各是什么元素并回答下列问题:
(1)写出它们的元素符号:A________,B________,C________,D________,E________。
(2)B、C、D的气态氢化物的稳定性由大到小的顺序为__________(用化学式表示)
(3)画出D的离子结构示意图________。
(4)用一个方程式证明B、E的非金属性的强弱_______________。
(5)写出E的最高价氧化物的一种用途:_________。
(6)由这五种元素组成的三核10电子的分子为________,四核10电子的分子是________。由这五种元素组成的四核18电子的分子为________,五核18电子的分子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验中,通常利用如图所示的装置进行喷泉实验,来验证气体的“溶解性”,下列有关说法不正确的是

A.用滴管加入液体后,由于气体的“溶解”,使瓶内压强减小,导致瓶内压强小于外界压强,从而形成喷泉
B.选用合适的溶液,CO2也能做喷泉实验
C.HCl、NH3和SO2均能用该装置做喷泉实验
D.用NO2气体做喷泉实验,烧瓶中将充满稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种酸性工业废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42-)中回收氧化铁的流程如图所示:
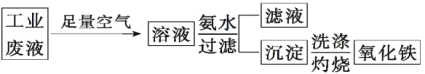
已知:常温下Ksp[Mg(OH)2]=1.2×10-11、Ksp[Fe(OH)2]=2.2×10-16、Ksp[Fe(OH)3]=3.5×10-38、Ksp[Al(OH)3]=1.0×10-33。
(1)写出在该酸性废液中通入空气时发生的反应的离子方程式:_________________,使用空气的优点是_____。
(2)常温下,在pH=5的溶液中Fe3+存在的最大浓度为_____。
(3)有人利用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用_____试剂可将其除去。
II.某研究性学习小组为探究Fe3+与Ag反应,进行如下实验:按下图连接装置并加入药品(盐桥中的物质不参与反应)。
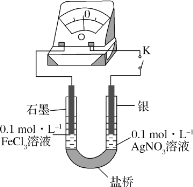
(4)K闭合时,指针向左偏转,石墨作____(填“正极”或“负极”)。
(5)当指针归零后,向左侧U形管中滴加几滴FeCl2浓溶液,发现指针向右偏转,写出此时银电极的反应式:_____。
(6)结合上述实验分析,写出Fe3+和Ag反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关文献记载中涉及的化学知识表述不正确的是( )
A.“以曾青涂铁,铁赤色如铜”说明我国古代就掌握了“湿法冶金”技术
B.“墙塌压糖,去土而糖白”中的脱色过程发生了化学变化
C.“丹砂烧之成水银,积变又还成丹砂”讲的是单质与化合物之间的互变
D.《本草纲目》中记载:“烧酒非古法也,……,用浓酒和糟入甑,蒸令气上,用器承取滴露。”涉及的操作方法是蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室检验某溶液中是否含有SO42-的操作方法是:_______________________;实验室检验某溶液中是否含有Cl-的操作方法是:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:

(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________ ,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③为__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应:3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是

A. 若t1=15s, A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.09 mol·L-1·s-1
B. t0~t1阶段,此过程中容器放出a kJ热量,该反应的热化学方程式为:3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
C. 该容器的容积为2 L,B的起始的物质的量为0.03 mol
D. t1时该反应达到平衡且A 的转化率为60%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com