
 .
. .
. .
. .
. :
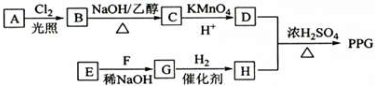
:分析 烃A的相对分子质量为70,由$\frac{70}{12}$=5…10,则A为C5H10,核磁共振氢谱显示只有一种化学环境的氢,故A的结构简式为 ;A与氯气在光照下发生取代反应生成单氯代烃B,则B为
;A与氯气在光照下发生取代反应生成单氯代烃B,则B为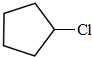 ,B发生消去反应生成C为
,B发生消去反应生成C为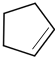 ,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(
,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(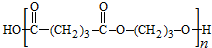 ),据此分析解答.
),据此分析解答.
解答 解:烃A的相对分子质量为70,由$\frac{70}{12}$=5…10,则A为C5H10,核磁共振氢谱显示只有一种化学环境的氢,故A的结构简式为 ;A与氯气在光照下发生取代反应生成单氯代烃B,则B为
;A与氯气在光照下发生取代反应生成单氯代烃B,则B为 ,B发生消去反应生成C为
,B发生消去反应生成C为 ,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(
,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(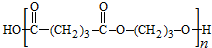 ),
),
(1)由上述分析可知,A的结构简式为 ,故答案为:
,故答案为: ;
;
(2)由B生成C的化学方程式为: ,
,
故答案为: ;
;
(3)由E和F生成G的反应类型为加成反应,G为HOCH2CH2CHO,化学名称为3-羟基丙醛,
故答案为:加成反应;3-羟基丙醛;
(4)①由D和H生成PPG的化学方程式为: ,
,
故答案为: ;
;
②若PPG平均相对分子质量为10000,则其平均聚合度约为$\frac{10000}{12×8+16×4+1×12}$≈58,故答案为:b;
(5)D的同分异构体中能同时满足①能与饱和NaHCO3溶液反应产生气体,含-COOH,②既能发生银镜反应,又能发生水解反应-COOCH,D中共5个C,则含3个C-C-C上的2个H被-COOH、-OOCH取代,共为3+2=5种,含其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是 ,D及同分异构体中组成相同,由元素分析仪显示的信号(或数据)完全相同,
,D及同分异构体中组成相同,由元素分析仪显示的信号(或数据)完全相同,
故答案为:5; ;c.
;c.
点评 本题考查有机物的推断,为高考常见题型,把握合成中碳链变化、官能团变化及反应条件推断物质为解答的关键,侧重分析与推断能力的综合考查,熟悉常见有机反应类型及有机物官能团及其性质关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Fe+CuSO4═FeSO4+Cu 氧化性Fe>Cu | |
| B. | Cl2+2KI═2KCl+I2氧化性Cl2>I2 | |
| C. | H2+CuO═Cu+H2O CuO是还原剂 | |
| D. | CaCO3+H2O+CO2═Ca(HCO3)2 是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
| 一氯乙酸 | K=1.4×10-3 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 ; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).
; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).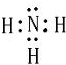 ;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).
;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体,Q和X形成的离子化合物XQ是碱石灰的主要成分,X、Y、Z位于同一周期,Y的外围电子数是最外层电子的6倍,Z位于ds区且不能和稀硫酸反应生成H2,请问答下列问题:
Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体,Q和X形成的离子化合物XQ是碱石灰的主要成分,X、Y、Z位于同一周期,Y的外围电子数是最外层电子的6倍,Z位于ds区且不能和稀硫酸反应生成H2,请问答下列问题: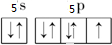 ,L的含氧酸HLO3中L的杂化方式为sp3,酸根LO3-的离子构型为三角锥形;
,L的含氧酸HLO3中L的杂化方式为sp3,酸根LO3-的离子构型为三角锥形;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com